
 3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下: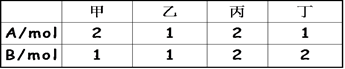


科目:高中化学 来源:不详 题型:计算题
 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2,反应达到平衡的标志是
2NO2,反应达到平衡的标志是| A.② | B.①② | C.②③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。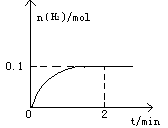
 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe(s)+CO2(g) △H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) △H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )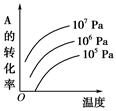
| A.正反应吸热:m+n>p+q | B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q | D.正反应放热:m+n<p+q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。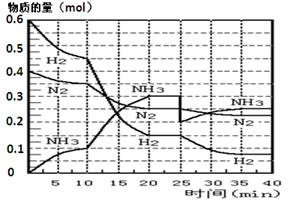
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) + 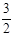 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
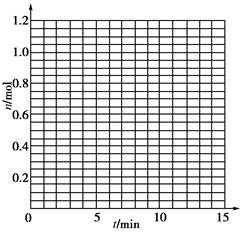
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
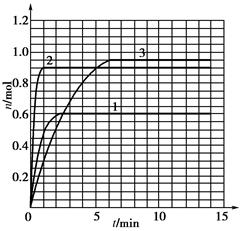
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是| A.若x=2,则p>0.5a | B.若x=3,则p<0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com