
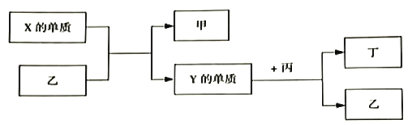
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )
A. 原子半径由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都只能形成两种化合物
【答案】C
【解析】
W、X、Y、Z 四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙分子均含有10个电子,由反应:单质X+乙→单质Y+甲,可知X为F2、乙为H2O、Y为O2、甲为HF,则W为H元素、X为F元素、Y为O元素,再由反应:丙+氧气→丁+水,可知丙是NH3或CH4,丁是NO或CO2,Z为C或N元素。
由分析可知,W为H元素、X为F元素、Y为O元素、Z为C或N元素、X为F2、Y为O2、甲为HF、乙为H2O、丙是NH3或CH4。
A.W为H元素,X为F元素,Y为O元素,Z为C或N元素,则原子半径由小到大的顺序是:W<X<Y<Z,A错误;
B.Z为C或N元素,其最高价氧化物对应的水化物为碳酸或硝酸,硝酸属于强酸,而碳酸是弱酸,B错误;
C.化合物甲是HF,乙是H2O、丙是NH3或CH4,水在室温下呈液态,HF、NH3分子之间存在氢键,增加了分子之间的吸引力,使物质的沸点增大,由于HF的分子的氢键比NH3的大,所以化合物的沸点由高到低的顺序是:乙>甲>丙;若丙是CH4,沸点比HF低,仍然存在关系乙>甲>丙,C正确;
D.O与H可生成H2O、H2O2,O可与C生成CO、CO2,与N生成NO、NO2、N2O3等多种氧化物,不是都只能形成两种化合物,D错误;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol/L的稀盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用________量筒。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度会______(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度会________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2与NO2的下列说法正确的是
A. 都能引起光化学烟雾 B. 都能使石蕊试液先变红后褪色
C. 都是酸性氧化物 D. 都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的是
A. 模拟工业制氨气并检验产物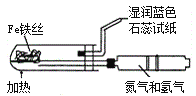
B. 实验室采用所示装置收集SO2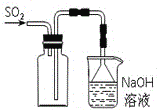
C. 验证KMnO4,Cl2,S 氧化性强弱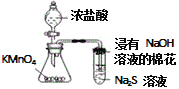
D. 验证铁发生析氢腐蚀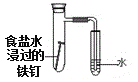
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国卫生组织经过考察和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广,其主要原因是( )
A.价格便宜,不易生锈B.有银白色金属光泽,导电性好
C.烹调的食物中留有人体需要的铁元素D.传热慢,保温性能好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置,测定工业纯碱(含有少量NaCl)中Na2CO3的含量.
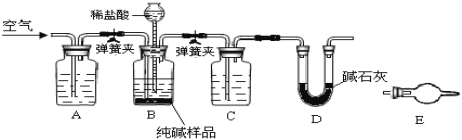
(1)检验装置B气密性:塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后D装置增重8.80g,则样品中Na2CO3质量分数为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O![]() H+ + Cl-+HClO
H+ + Cl-+HClO
B. CaCO3加入醋酸中:CO![]() + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() H2↑+ Cl2↑ +2OH-
H2↑+ Cl2↑ +2OH-
D. 酸性KMnO4溶液滴入FeSO4溶液中:MnO![]() + Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com