
| A. | CH2=C(CH2CH3)C (CH3)3 | B. | CH2=C(CH3)C(CH3)2CH2CH3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
分析 2,2,3-三甲基戊烷的碳链结构为 ,根据各物质与氢气完全加成后的产物与2,2,3-三甲基戊烷的碳链结构相比较判断正误.
,根据各物质与氢气完全加成后的产物与2,2,3-三甲基戊烷的碳链结构相比较判断正误.
解答 解:A.CH2=C(CH2CH3)C (CH3)3与氢气完全加成后产物的碳链结构为 ,碳链结构相同,故A正确;
,碳链结构相同,故A正确;
B.CH2=C(CH3)C(CH3)2CH2CH3与氢气完全加成后产物的碳链结构为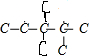 ,碳链结构不相同,故B错误;
,碳链结构不相同,故B错误;
C.HC≡CCH(CH3)C(CH3)3与氢气完全加成后产物的碳链结构为 ,碳链结构相同,故C正确;
,碳链结构相同,故C正确;
D.(CH3)3CC(CH3)=CHCH3与氢气完全加成后产物的碳链结构为 ,碳链结构相同,故D正确.
,碳链结构相同,故D正确.
故选B.
点评 本题主要考查加成反应,难度中等,关键清楚不饱和烃的加成原理,也可通过去相邻两个C原子的H原子还原不饱和键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
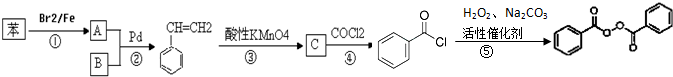
 ;
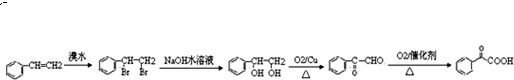
;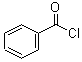 +H2O2$→_{碳酸钠}^{催化剂}$
+H2O2$→_{碳酸钠}^{催化剂}$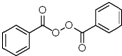 +2HCl;
+2HCl;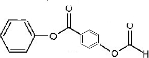 或
或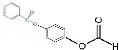 ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
; ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ②③④⑤⑥⑦⑧ | C. | ②④⑦ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有达到平衡时,消耗O2的速率与生成NO的速率之比才为5;4 | |
| B. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 | |
| C. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量保持不变 | |
| D. | 达到平衡状态时,若增加容器体积,则反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素分布于短周期和长周期里,而副族元素仅分布于长周期里 | |
| B. | 元素周期表中,位于同一主族的元素的原子最外层电子数相同,且等于族序数 | |
| C. | 元素周期表中,周期的序数就是该周期元素原子具有的电子层数 | |
| D. | 元素周期表有7个横行,7个周期;18个纵列,18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gCH2=CH2含有NA个碳原子 | |
| B. | 1mol苯含有3NA个碳碳单键和3NA个碳碳双键 | |
| C. | 标准状况下,22.4L正戊烷含有12NA个氢原子 | |
| D. | 常温常压下,16gCH4含有4NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )| A. | 分子中至少有6个碳原子共平面 | B. | 分子中至少有8个碳原子共平面 | ||
| C. | 分子中至少有9个碳原子共平面 | D. | 分子中至少有14个碳原子共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com