
×ćĮæZn·ŪÓė50ml”¢ 0£®1mol/LµÄĻ”ĮņĖį³ä·Ö·“Ó¦”£ĪŖĮĖ¼õĀż“Ė·“Ó¦ĖŁĀŹ¶ų²»øıäH2µÄ²śĮ棬æÉŅŌŹ¹ÓĆČēĻĀ·½·ØÖŠµÄ£Ø £©
¢Ł¼ÓNa2SO4ČÜŅŗ£»¢ŚøÄÓĆ50ml”¢0£®1mol/LµÄĻ”ŃĪĖį£»¢ŪøÄÓĆ50ml”¢0£®05mol/LµÄĻõĖį£»
¢Ü¼ÓŹŹĮæ¹ĢĢå“×ĖįÄĘ£»¢Ż¼õŃ¹£»¢Ž±łĖ®Ō”£»¢ß¼ÓNaCO3ČÜŅŗ£»¢ą“æZnøÄĪŖ²»“æµÄZn
A£®¢Ł¢Ü¢Ž B£®¢Ū¢Ż¢Ž¢ß¢ą C£®¢Ł¢Ś¢Ż¢Ž D£®Č«²æ
A
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲÓŠĪĀ¶Č£¬ÅØ¶Č£¬Ń¹Ē棬“߻ƼĮ£¬¹ĢĢå·“Ó¦ĪļµÄ½Ó“„Ć껿£¬ĮņĖįÓėŠæ·“Ó¦µÄŹµÖŹŹĒĒāĄė×ÓÓėŠæ·“Ӧɜ³ÉŠæĄė×ÓŗĶĒāĘų£¬¹Ź
¢Ł¼ÓNa2SO4ČÜŅŗĻąµ±ÓŚĻ”ŹĶ·“Ó¦ĪļĮņĖįµÄÅØ¶Č£¬¹Ź·“Ó¦ĖŁĀŹ¼õĀż£¬µ«²»øıäĒāĘųµÄ²śĮ攣¢ŚøÄÓĆ50ml”¢0£®1mol/LµÄĻ”ŃĪĖį»įŌö¼ÓĒāĄė×ÓÅØ¶Č£¬»įøıäŌö“ó²śÉśĒāĘųµÄĮ攣¹Ź¢Ś“ķ”££»¢ŪøÄÓĆ50ml”¢0£®05mol/LµÄĻõĖį£»ĻõĖįÓėŠæ·“Ó¦²»²śÉśĒāĘų£¬¹Ź¢Ū“ķ”£¢Ü¼ÓŹŹĮæ¹ĢĢå“×ĖįÄĘ£¬“×ĖįøłĄė×ÓæÉŅŌÓėĒāĄė×ÓŠĪ³ÉČõĖį“×Ėį£¬æÉŅŌ¼õĀż»Æѧ·“Ó¦µÄĖŁĀŹ£¬µ«²»øıäĒāĘųµÄĮ棬¹Ź¢ÜÕżČ·£¬¢Ż¼õŃ¹£¬¼õŃ¹ĻņĢå»żŌö“óµÄ·½Ļņ½ųŠŠ¼“ĻņÕż·“Ó¦·½Ļņ£¬»į¼Óæģ²śÉśĒāĘųµÄĖŁĀŹ£¬¹Ź¢Ż“ķ”£¢Ž±łĖ®Ō”Ļąµ±ÓŚ½µµĶĪĀ¶Č£¬·“Ó¦ĖŁĀŹ»į¼õĀż£¬¹Ź¢ŽÕżČ·”££»¢ß¼ÓNaCO3ČÜŅŗÖŠµÄĢ¼ĖįøłĄė×Ó»įĻūŗÄČÜŅŗÖŠŅ»²æ·ÖµÄĒāĄė×Ó£¬»įøıäĒāĘųµÄ²śĮæ¹Ź¢ß“ķ£¬
¢ą“æZnøÄĪŖ²»“æµÄZn£¬æÉŠĪ³ÉĪ¢Š”Ōµē³Ų£¬¼Óæģ·“Ó¦ĖŁĀŹµÄ½ųŠŠ£¬¹Ź¢ą“ķ”£
æ¼µć£ŗæ¼²éÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹŅņĖŲµÄĻą¹ŲÖŖŹ¶µć”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”ĆąŃōŹŠøßČżµŚČż“ĪÕļ¶ĻŠŌæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³£ĪĀĻĀ£¬½«20mL0£®1mol/LµÄHClČÜŅŗÖšµĪ¼ÓČėµ½20mL0£®1mol/LNa2C2O4ČÜŅŗÖŠ”£ŅŃÖŖNaHC2O4ČÜŅŗĻŌĖįŠŌ£¬¹ŲÓŚ·“Ó¦»ģŗĻČÜŅŗµÄĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
A£® c(Na+)£¾c(Cl-)£¾c(HC2O4-)£¾c(C2O42-)£¾c(HC2O4)
B£® 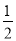 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
C£® c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4)
D£® ¼ÓĖ®Ļ”ŹĶŹ±£¬ČÜŅŗÖŠc(OH-)Ōö“ó£¬ĘäÓąĄė×ÓÅØ¶Č¾ł¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”ÅŹÖ¦»ØŹŠøßŅ»£ØĻĀ£©Ń§ĘŚµ÷ŃŠ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŗ£Ė®×ŹŌ“µÄ×ŪŗĻĄūÓĆŹ®·ÖÖŲŅŖ£¬²»ŠčŅŖĶعż»Æѧ±ä»Æ¾ĶÄܹ»“Óŗ£Ė®ÖŠ»ńµĆµÄĪļÖŹŹĒ
A£®Ź³ŃĪ B£®ÄĘ C£®äå D£®µā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”³É¶¼ŹŠøßµŚ¶žĘŚĘŚÄ©øßŅ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
X”¢Y”¢Z”¢W”¢QĪåÖÖĒ°ĖÄÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó”£ŅŃÖŖĪåÖÖŌŖĖŲÖŠÖ»ÓŠŅ»ÖÖĪŖ½šŹōŌŖĖŲ£¬ XW2ŹĒĶس£³ŹŅŗĢ¬µÄÓŠ»śĪļ£¬ŌŖĖŲWµÄŌ×ÓŠņŹżµČÓŚŌŖĖŲZµÄŌ×ÓŠņŹż¼Ó8£¬QµÄ×īĶā²ćµē×ÓŹżĪŖ1£¬“ĪĶā²ćµē×ÓŹżµČÓŚYŗĶW2 - ×īĶā²ćµē×ÓŹżÖ®ŗĶ”£øł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ£ØÓĆŌŖĖŲ·ūŗÅ»ņ»ÆѧŹ½µČ»ÆѧÓĆÓļ»Ų“š£©
£Ø1£©XW2µÄµē×ÓŹ½ĪŖ ”£
£Ø2£©YŌ×ÓÖŠµē×ÓŌĖ¶ÆדĢ¬ÓŠ ÖÖ£¬ ZµÄĘųĢ¬Ēā»ÆĪļŌŚĶ¬Ö÷×åŌŖĖŲĘųĢ¬Ēā»ÆĪļÖŠ×īøߏĒŅņĪŖ ”£
£Ø3£©QŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ £¬Ę仳Ģ¬Ō×Ó¼ņ»Æµē×ÓÅŲ¼Ź½ĪŖ ”£½»¾ÆæÉŅŌÓĆH2SO4Ėį»ÆµÄK2 Cr2O7ČÜŅŗ¼ģ²ā¼ŻŹ»Ō±ŹĒ·ń¾Ę¼Ż£¬Ęä²śĪļĪŖŅŅĖį”¢Q3+µČ”£
ĒėŠ“³ö“ĖŌĄķµÄĄė×Ó·½³ĢŹ½ ”£
£Ø4£©ŗ¬WµÄĮ½ÖÖŌŖĖŲÖÖĄąĻąĶ¬µÄĖįŹ½ļ§ŃĪČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½
ӣ
£Ø5£©Ä³ÖÖČ¼ĮĻµē³ŲŅ»¼«ĶØŅŅ“¼µÄ×ī¼ņµ„Ķ¬ĻµĪļÕōĘų£¬Ņ»¼«ĶØZ2£¬ŅŌNaOHČÜŅŗĪŖµē½āŅŗ”£ĒėŠ“³öøĆŌµē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”³É¶¼ŹŠøßµŚ¶žĘŚĘŚÄ©øßŅ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ļņŗ¬ÓŠ0£®2 mol NaOHŗĶ0£®1 mol Ba(OH)2µÄČÜŅŗÖŠ³ÖŠųĪČ¶ØµŲĶØČėCO2ĘųĢ壬µ±ĶØČėĘųĢåĪŖ8£®96L(0”ę£¬1£®01”Į105 Pa)Ź±Į¢¼“Ķ£Ö¹£¬ŌņÕāŅ»¹ż³ĢÖŠ£¬ČÜŅŗÖŠĄė×ÓµÄĪļÖŹµÄĮæÓėĶØČėCO2ĘųĢåµÄĢå»ż¹ŲĻµĶ¼ĻóÕżČ·µÄŹĒ(²»æ¼ĀĒĘųĢåµÄČܽāŗĶĄė×ÓÓėĖ®·“Ó¦) £Ø £©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”³É¶¼ŹŠøßµŚ¶žĘŚĘŚÄ©øßŅ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŗ£Ė®µÄ×ŪŗĻĄūÓĆæÉŅŌÖʱø½šŹōÄĘŗĶĆ¾µČ£¬ĘäĮ÷³ĢČēĻĀĶ¼ĖłŹ¾£ŗ
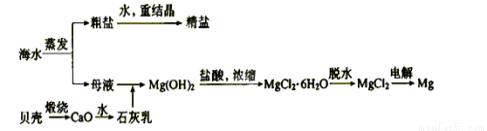
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ £Ø £©
A£®ŗ£Ė®ĢįŃĪ¶¼ŹōÓŚĪļĄķ±ä»Æ
B£®ĄūÓĆÄøŅŗæɽųŅ»²½ĢįČ”ä壬µ«ŅŖø»¼Æ
C£®ÉĻŹöĮ÷³ĢÖŠÉś³ÉMg(OH)2³ĮµķµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗMg2++Ca(OH)2= Mg(OH)2+Ca2+
D£®²»ÓƵē½āMgOĄ“ÖĘČ”Ć¾ŹĒŅņĪŖMgOČŪµćøߣ¬ÄÜŗÄ“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”³É¶¼ŹŠøßµŚ¶žĘŚĘŚÄ©øßŅ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
»ÆѧÓė»·¾³”¢Éś²ś”¢Éś»īĆÜĒŠĻą¹Ų£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A£®³É¶¼¼Óæģ½ØÉčµŲĢś”¢Ēį¹ģ£¬¼õÉŁĘū³µĪ²ĘųÅÅ·Å£¬·ūŗĻ”°µĶĢ¼¾¼Ć”±ŅŖĒó
B£®ĀĢÉ«»ÆѧµÄŗĖŠÄŹĒÓ¦ÓĆ»ÆѧŌĄķ¶Ō»·¾³ĪŪČ¾½ųŠŠÖĪĄķ
C£®ÓĆ½žÅŻ¹żøßĆĢĖį¼ŲČÜŅŗµÄ¹čĶĮĪüŹÕĖ®¹ūŹĶ·ÅµÄŅŅĻ©£¬ÓŠĄūÓŚĖ®¹ū±£ĻŹ
D£®Ć÷·ÆĖ®ČÜŅŗÖŠµÄĒāŃõ»ÆĀĮ½ŗĢåÄÜĪüø½Ė®ÖŠŠüø”Īļ£¬“ļµ½¾»Ė®ÄæµÄ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”³É¶¼ŹŠĪ劣øßŅ»ĻĀѧʌʌ֊ĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¶ŌÓŚA2£«3B2  2CµÄ·“Ó¦Ą“Ėµ£¬ŅŌĻĀ»Æѧ·“Ó¦ĖŁĀŹµÄ±ķŹ¾ÖŠ£¬·“Ó¦ĖŁĀŹ×īæģµÄŹĒ (””””)
2CµÄ·“Ó¦Ą“Ėµ£¬ŅŌĻĀ»Æѧ·“Ó¦ĖŁĀŹµÄ±ķŹ¾ÖŠ£¬·“Ó¦ĖŁĀŹ×īæģµÄŹĒ (””””)
A”¢v(B2)£½0.8 mol”¤L£1”¤s£1
B”¢v(A2)£½0.4 mol”¤L£1”¤s£1
C”¢v(C)£½0.6 mol”¤L£1”¤s£1
D”¢v(B2)£½4.2 mol”¤L£1”¤min£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ĖÄ“ØŹ”ŅĖ²żŹŠ“ŗ¼¾ĘŚÖŠæ¼ŹŌø߶ž»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
²ŻĖįŹĒ¶žŌŖČõĖį£¬²ŻĖįĒā¼ŲČÜŅŗ³ŹĖįŠŌ”£ŌŚ0.1mol”¤L£1 KHC2O4ČÜŅŗÖŠ£¬ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ
A£®c(K+)+c(H+) = c(HC2O4£)+c(OH£)+c(C2O42£)
B£®c(HC2O4£)+c(C2O42£) = 0.1 mol”¤L£1
C£®c(C2O42£) < c(H2C2O4)
D£®c(K+) = c(H2C2O4)+c(HC2O4£)+c(C2O42£)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com