

| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Co£ØOH£©2 | Al£ØOH£©3 | Mn£ØOH£©2 |
| æŖŹ¼³Įµķ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ĶźČ«³Įµķ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
·ÖĪö ŗ¬īÜ·ĻĮĻÖŠ¼ÓČėŃĪĖį£¬¼ÓČėŃĪĖįŗĶŃĒĮņĖįÄĘ£¬æɵĆCoCl2”¢AlCl3”¢FeCl2£¬¼ÓČėNaClO3£¬æɵƵ½FeCl3£¬Č»ŗó¼ÓČėNa2CO3µ÷pHÖĮ5.2£¬æɵƵ½Fe£ØOH£©3”¢Al£ØOH£©3³Įµķ£¬¹żĀĖŗóĖłµĆĀĖŅŗÖ÷ŅŖŗ¬ÓŠCoCl2£¬ĪŖµĆµ½CoCl2•6H2O¾§Ģ壬ӦæŲÖĘĪĀ¶ČŌŚ86”ęŅŌĻĀ£¬¼ÓČČŹ±ŅŖ·ĄÖ¹ĪĀ¶Č¹żø߶ųŹ§Č„½į¾§Ė®£¬æɼõŃ¹ŗęøÉ£¬
£Ø1£©øł¾ŻĮ÷³ĢĶ¼½įŗĻŠÅĻ¢½ž³öŅŗŗ¬ÓŠµÄŃōĄė×ÓÖ÷ŅŖÓŠH+”¢Co2+”¢Fe2+”¢Mn2+”¢Al3+µČ½ųŠŠ½ā“š£»
£Ø2£©NaClO3µÄ×÷ÓĆŹĒ½«Fe2+Ńõ»Æ³ÉFe3+£»ŌŚĖįŠŌĢõ¼žĻĀ£¬NaClO3ÓėĀČĄė×Ó·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĀČĘų£»
£Ø3£©øł¾ŻĀĮĄė×Ó”¢ĢśĄė×ÓÄÜÓėĢ¼ĖįøłĄė×Ó·¢ÉśĖ«Ė®½āÉś³É³ĮµķŗĶ¶žŃõ»ÆĢ¼½ųŠŠ½ā“š£¬ÓɱķÖŠŹż¾ŻæÉÖŖ£¬µ÷½ŚČÜŅŗPHŌŚ3.0”«3.5Ö®¼ä£¬æÉŹ¹Mn2+ĶźČ«³Įµķ£¬²¢·ĄÖ¹Co2+×Ŗ»ÆĪŖCo£ØOH£©2³Įµķ£»
£Ø4£©CoCl2•6H2OČŪµćĪŖ86”ę£¬¼ÓČČÖĮ110”«120”ꏱ£¬Ź§Č„½į¾§Éś³ÉĪŽĖ®ĀČ»ÆīÜ£»
£Ø5£©øł¾ŻCoCl2•6H2OµÄ×é³É·ÖĪö£¬æÉÄÜŹĒŗ¬ÓŠŌÓÖŹ£¬Ņ²æÉÄÜŹĒŹ§Č„²æ·ÖĖ®£®
½ā“š ½ā£ŗŗ¬īÜ·ĻĮĻÖŠ¼ÓČėŃĪĖį£¬¼ÓČėŃĪĖįŗĶŃĒĮņĖįÄĘ£¬æɵĆCoCl2”¢AlCl3”¢FeCl2£¬¼ÓČėNaClO3£¬æɵƵ½FeCl3£¬Č»ŗó¼ÓČėNa2CO3µ÷pHÖĮ5.2£¬æɵƵ½Fe£ØOH£©3”¢Al£ØOH£©3³Įµķ£¬¹żĀĖŗóĖłµĆĀĖŅŗÖ÷ŅŖŗ¬ÓŠCoCl2£¬ĪŖµĆµ½CoCl2•6H2O¾§Ģ壬ӦæŲÖĘĪĀ¶ČŌŚ86”ęŅŌĻĀ£¬¼ÓČČŹ±ŅŖ·ĄÖ¹ĪĀ¶Č¹żø߶ųŹ§Č„½į¾§Ė®£¬æɼõŃ¹ŗęøÉ£¬
£Ø1£©ĻņĖ®īÜæó[Ö÷ŅŖ³É·ÖĪŖCo2O3”¢Co£ØOH£©3£¬»¹ŗ¬ÉŁĮæFe2O3”¢Al2O3”¢MnOµČ]£¬¼ÓČėŃĪĖįŗĶŃĒĮņĖįÄĘ£¬½ž³öŅŗŗ¬ÓŠµÄŃōĄė×ÓÖ÷ŅŖÓŠH+”¢Co2+”¢Fe2+”¢Mn2+”¢Al3+µČ£¬ĖłŅŌCo2O3ŗĶŃĒĮņĖįÄĘŌŚĖįŠŌĢõ¼žĻĀ·¢ÉśŃõ»Æ»¹Ō£¬øł¾ŻµēŗÉŹŲŗćŗĶµĆŹ§µē×ÓŹŲŗć£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCo2O3+SO32-+4H+=2Co2++SO42-+2H2O£¬
¹Ź“š°øĪŖ£ŗCo2O3+SO32-+4H+=2Co2++SO42-+2H2O£»
£Ø2£©NaClO3µÄ×÷ÓĆŹĒ½«Fe2+Ńõ»Æ³ÉFe3+£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O£»ŌŚĖįŠŌĢõ¼žĻĀ£¬NaClO3ÓėĀČĄė×Ó·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĀČĘų£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗClO3-+5Cl-+6H+=3Cl2”ü+3H2O£»
¹Ź“š°øĪŖ£ŗClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O£»ClO3-+5Cl-+6H+=3Cl2”ü+3H2O£»
£Ø3£©NaClO3µÄ×÷ÓĆŹĒ½«Fe2+Ńõ»Æ³ÉFe3+£¬¼ÓNa2CO3µ÷pHÖĮa£¬ĀĮĄė×ÓÄÜÓėĢ¼ĖįøłĄė×Ó·¢ÉśĖ«Ė®½āÉś³ÉĒāŃõ»ÆĀĮŗĶ¶žŃõ»ÆĢ¼£¬Ė®½āµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2Al3++3CO32-+3H2O=2Al£ØOH£©3”ż+3CO2”ü£»ĢśĄė×ÓÄÜÓėĢ¼ĖįøłĄė×Ó·¢ÉśĖ«Ė®½āÉś³ÉĒāŃõ»ÆĢśŗĶ¶žŃõ»ÆĢ¼£¬Ė®½āµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2Fe3++3CO32-+3H2O=2Fe£ØOH£©3”ż+3CO2”ü£¬ĖłŅŌ³Įµķ³É·ÖĪŖ£ŗFe£ØOH£©3”¢Al£ØOH£©3£¬øł¾ŻĮ÷³ĢĶ¼æÉÖŖ£¬“ĖŹ±ČÜŅŗÖŠ“ęŌŚMn2+”¢Co2+½šŹōĄė×Ó£¬ÓÉŻĶČ”¼Į¶Ō½šŹōĄė×ӵįĶČ”ĀŹÓėpHµÄ¹ŲĻµæÉÖŖ£¬µ÷½ŚČÜŅŗPHŌŚ3.0”«3.5Ö®¼ä£¬æÉŹ¹Mn2+ĶźČ«³Įµķ£¬²¢·ĄÖ¹Co2+×Ŗ»ÆĪŖCo£ØOH£©2³Įµķ£¬
¹Ź“š°øĪŖ£ŗFe£ØOH£©3”¢Al£ØOH£©3£»³żČ„ČÜŅŗÖŠµÄMn2+£»
£Ø4£©CoCl2•6H2OČŪµćĪŖ86”ę£¬¼ÓČČÖĮ110”«120”ꏱ£¬Ź§Č„½į¾§Éś³ÉĪŽĖ®ĀČ»ÆīÜ£¬ĖłŅŌ½µµĶŗęøÉĪĀ¶Č£¬·ĄÖ¹²śĘ··Ö½ā£¬
¹Ź“š°øĪŖ£ŗ½µµĶŗęøÉĪĀ¶Č£¬·ĄÖ¹²śĘ··Ö½ā£»
£Ø5£©øł¾ŻCoCl2•6H2OµÄ×é³É·ÖĪö£¬Ōģ³É²śĘ·ÖŠCoCl2•6H2OµÄÖŹĮæ·ÖŹż“óÓŚ100%µÄŌŅņæÉÄÜŹĒ£ŗŗ¬ÓŠŌÓÖŹ£¬µ¼ÖĀĀČĄė×Óŗ¬Įæ“ó»ņ½į¾§Ė®»ÆĪļŹ§Č„²æ·ÖĖ®£¬µ¼ÖĀĻąĶ¬ÖŹĮæµÄ¹ĢĢåÖŠĀČĄė×Óŗ¬Įæ±ä“ó£¬
¹Ź“š°øĪŖ£ŗ“Ö²śĘ·ŗ¬ÓŠæÉČÜŠŌĀČ»ÆĪļ»ņ¾§ĢåŹ§Č„ĮĖ²æ·Ö½į¾§Ė®£®
µćĘĄ ±¾ĢāĶعżÖĘČ”CoCl2•6H2OµÄ¹¤ŅÕĮ÷³Ģ£¬æ¼²éĮĖĪļÖŹÖʱø·½°øµÄÉč¼Ę£¬ĢāÄæÄѶČÖŠµČ£¬Ąķ½ā¹¤ŅÕĮ÷³ĢĶ¼”¢Ć÷Č·ŹµŃé²Ł×÷ÓėÉč¼Ę¼°Ļą¹ŲĪļÖŹµÄŠŌÖŹŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£¬ŹŌĢā³ä·Öæ¼²éĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°Įé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹ÓĆ“ß»Æ¼Į»įŹ¹K±ä»Æµ«”÷H²»±ä | |
| B£® | Ź¹ÓĆ“ß»Æ¼Į»įŹ¹”÷HŌö“󣬵«K²»±ä | |
| C£® | Ź¹ÓĆ“ß»Æ¼ĮŗĶĢįøßĪĀ¶Č¾łæÉŌö“óH2µÄ×Ŗ»ÆĀŹ | |
| D£® | ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėÅØ¶Č¾łĪŖ1mol•L-1µÄ N2”¢H2”¢NH3£¬Ę½ŗāĒ°v£ØÕż£©£¾v£ØÄę£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«ŠĀÖĘĀČĖ®±£“ęŌŚ×ŲÉ«ŹŌ¼ĮĘæÖŠ | |
| B£® | ½«NaOHČÜŅŗ±£“ęŌŚ“ų²£Į§ČūµÄĻøæŚŹŌ¼ĮĘæÖŠ | |
| C£® | ½«ÉŁĮæ¼Ų”¢Äʱ£“ęŌŚĆŗÓĶÖŠ | |
| D£® | ½«ÅØĻõĖįČÜŅŗ±£“ęŌŚ×ŲÉ«ŹŌ¼ĮĘæÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×Ó°ė¾¶“óŠ”Ė³Šņ£ŗr£ØZ£©£¾r£ØW£©£¾r£ØX£©£¾r£ØY£© | |
| B£® | Y·Ö±šÓėZ”¢WŠĪ³ÉµÄ»ÆŗĻĪļÖŠ»Æѧ¼üĄąŠĶĻąĶ¬ | |
| C£® | XµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌ±ČWµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌĒæ | |
| D£® | YµÄ¼ņµ„Ēā»ÆĪļµÄČČĪČ¶ØŠŌ±ČWµÄĒæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LCHCl3ÖŠŗ¬ÓŠµÄĀČŌ×ӵďżÄæĪŖ3NA | |
| B£® | 25”ę”¢101kPaĻĀ£¬16gO3ŗĶO2»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄŃõŌ×ÓŹżĪŖNA | |
| C£® | µČÖŹĮæµÄN2ŗĶCOĖłŗ¬·Ö×ÓŹżĻąĶ¬ĒŅ¾łĪŖNA | |
| D£® | Ņ»¶ØĪĀ¶ČĻĀ£¬1L 1mol•L-1µÄCH3COONaČÜŅŗŗ¬NAøöCH3COO- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | v£ØN2£©=1.5 mol•£ØL•min£©-1 | B£® | v£ØNH3£©=1.8 mol•£ØL•min£©-1 | ||
| C£® | v£ØH2O£©=2.67 mol•£ØL•min£©-1 | D£® | v£ØO2£©=1.5 mol•£ØL•min£©-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ½šŹōÄų¼°Ęä»ÆŗĻĪļŌŚŗĻ½š²ÄĮĻŅŌ¼°“߻ƼĮµČ·½ĆęÓ¦ÓĆ¹ć·ŗ£®
½šŹōÄų¼°Ęä»ÆŗĻĪļŌŚŗĻ½š²ÄĮĻŅŌ¼°“߻ƼĮµČ·½ĆęÓ¦ÓĆ¹ć·ŗ£® ”¢¢ÜHCHO£¬ĘäÖŠĢ¼Ō×Ó²ÉČ”sp2ŌӻƵķÖ×ÓÓŠ¢Ł¢Ū¢Ü£ØĢīĪļÖŹŠņŗÅ£©£¬HCHO·Ö×ÓµÄĮ¢Ģå½į¹¹ĪŖĘ½ĆęČż½ĒŠĪ£®
”¢¢ÜHCHO£¬ĘäÖŠĢ¼Ō×Ó²ÉČ”sp2ŌӻƵķÖ×ÓÓŠ¢Ł¢Ū¢Ü£ØĢīĪļÖŹŠņŗÅ£©£¬HCHO·Ö×ÓµÄĮ¢Ģå½į¹¹ĪŖĘ½ĆęČż½ĒŠĪ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
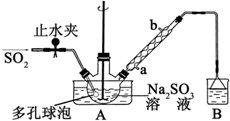 “ĪĮņĖįĒāÄĘ¼×Č©£ØNaHSO2•HCHO•2H2O£©Ė×³Ęµõ°×æ飬²»ĪČ¶Ø£¬120”ꏱ»į·Ö½ā£®ŌŚÓ”Č¾”¢Ņ½Ņ©ŅŌ¼°Ō×ÓÄܹ¤ŅµÖŠÓŠ¹ć·ŗÓ¦ÓĆ£®ŅŌNa2SO3”¢SO2”¢HCHOŗĶŠæ·ŪĪŖŌĮĻÖʱø“ĪĮņĖįĒāÄĘ¼×Č©µÄŹµŃé²½ÖčČēĶ¼£ŗ
“ĪĮņĖįĒāÄĘ¼×Č©£ØNaHSO2•HCHO•2H2O£©Ė×³Ęµõ°×æ飬²»ĪČ¶Ø£¬120”ꏱ»į·Ö½ā£®ŌŚÓ”Č¾”¢Ņ½Ņ©ŅŌ¼°Ō×ÓÄܹ¤ŅµÖŠÓŠ¹ć·ŗÓ¦ÓĆ£®ŅŌNa2SO3”¢SO2”¢HCHOŗĶŠæ·ŪĪŖŌĮĻÖʱø“ĪĮņĖįĒāÄĘ¼×Č©µÄŹµŃé²½ÖčČēĶ¼£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com