
| A. | 在溴水中存在如下平衡:Br2+H2O=HBr+HBrO,当加入NaOH溶液后颜色变浅 | |
| B. | 对2HI?H2+I2(气)平衡体系增加压强使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO+Q升高温度使平衡向逆方向移动 | |
| D. | 合成氨反应:N2+3H2?2NH3+Q,为使氨的产率提高,理论上应采取低温高压的措施 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;只有改变条件时能引起平衡移动的可逆反应才能用平衡移动原理解释.
解答 解:A.加入NaOH溶液后,NaOH和HBr、HBrO发生中和反应而促进溴和水反应,平衡正向移动,所以溶液颜色变浅,则可以用平衡移动原理解释,故A不选;
B.该反应前后气体体积不变,压强不影响平衡移动,所以不能用平衡移动原理解释,故B选;
C.该反应是放热反应,升高温度平衡逆向移动,可以用平衡移动原理解释,故C不选;
D.该反应的正反应是一个反应前后气体体积减小的放热反应,降低温度平衡正向移动、增大压强平衡正向移动,所以可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生分析判断能力,明确平衡移动原理内涵及其适用范围是解本题关键,注意:不能引起平衡移动的条件不能用平衡移动原理解释,易错选项是B.


科目:高中化学 来源: 题型:选择题
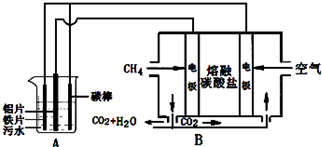
| A. | 装置A中碳棒为阴极 | |
| B. | 污水中加入适量的硫酸钠,可增强溶液的导电性 | |
| C. | 装置B中通入空气的电极反应是O2+2H2O+4e-=4OH- | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: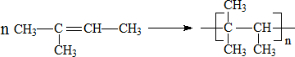 .
.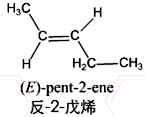 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
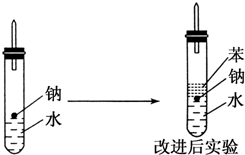 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a≤b时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2═CO32-+HCO3-+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com