
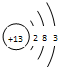 ���ʴ�Ϊ��
���ʴ�Ϊ��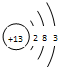 ��
��
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=12�ij������Һ�У�K+��Na+��MnO4-��SO42- |
| B��c��Al3+��=0.1mol?L-1����Һ�У�Na+��Cl-��HCO3-��SO42- |
| C�����ȳʺ�ɫ����Һ�У�NH4+��Ba2+��AlO2-��Cl- |
| D�������������ۺ��ܲ�����������Һ�У�NH4+��Fe2+��NO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ΪNH3��ˮ��Һ���Ե��磬����NH3�ǵ���� |
| B����ΪSO2����ʹ��ˮ��ɫ������SO2����Ư���� |
| C����Ϊij������Һ����ɫ�ʻ�ɫ������������ΪNaOH |
| D����ΪAl����ǿ����Һ��Ӧ������Al��һ���ķǽ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y | Z | |
| ��һ�����ܣ�KJ/mol�� | 520.2 | 495.8 | 418.8 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 30 | 50 | 70 |
| H3BO3���ʵ���/mol | 1 | 0.8 | 0.4 |

| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�H2��O2��11.2L���ϣ��������������������ΪNA |
| B��1.8g��NH4+�У�������������ΪNA |
| C��7g��ϩ�ͱ�ϩ�Ļ�����У�����ԭ������ΪNA |
| D��1 mol?L-1��NaOH��Һ�У�����Na+����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��33.6L����������������ַ�Ӧ��ת�Ƶĵ�����Ϊ3NA |
| B��1L 0.1mol?L-1������ͭ��Һ�к�ͭ������Ϊ0.1NA |
| C��0.1mol18Oԭ���к��е�������ΪNA |
| D��4.6gNO2�к��е�ԭ����Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2.4gþ�����������ᷴӦʱʧȥ0.1NA������ |
| B������0.1NA��CO32-��Na2CO3���������Ϊ10.6g |
| C��0.5mol�����������е���ԭ������NA��CO2�����������е���ԭ������� |
| D�����³�ѹ�£�11.2L����������ԭ����ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com