
【题目】6.5g Zn在与足量盐酸反应时产生的H2 在标准状况下的体积是多少升?
__________________________________
【答案】解:设产生H2的体积为V(H2 )
Zn+2HCl=ZnCl2+H2 ![]()
![]()
65g 22.4L
6.5g V(H2)
V(H2)= ![]() =2.24L
=2.24L
答:产生的H2在标准状况下的体积是2.24L。
【解析】
解法一:6.5g Zn在与足量盐酸反应,说明Zn完全反应,设产生H2的体积为V(H2 )
根据化学反应Zn+2HCl=ZnCl2+H2 ![]()
65g 22.4L
6.5g V(H2)
V(H2)= ![]() =2.24L
=2.24L
答:产生的H2在标准状况下的体积是2.24L。
解法二:根据化学反应Zn+2HCl=ZnCl2+H2 ![]() 可知消耗1molZn则生成1mol H2,6.5g Zn锌的物质的量为6.5g÷65g/mol=0.1mol,所以生成0.1mol H2,标况下的体积为0.1mol×22.4L/mol=2.24L。
可知消耗1molZn则生成1mol H2,6.5g Zn锌的物质的量为6.5g÷65g/mol=0.1mol,所以生成0.1mol H2,标况下的体积为0.1mol×22.4L/mol=2.24L。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制氧气 | H2O2―→O2 | |
② | 制氨气 | NH4Cl―→NH3 | |
③ | 制氯气 | HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是____填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中_______。
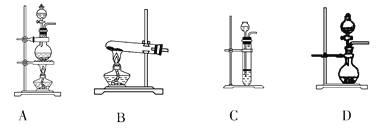
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的______填序号):

②配制过程中,除上图所列仪器外,还需要的仪器有________、________、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基磺酸镍[Ni(H2NSO3)2]是工业电镀镍所必需的化工原料,某科研小组先用尿素、SO3合成中间体氨基磺酸(H2NSO3H),再用氨基磺酸、金属镍和双氧水反应来合成氨基磺酸镍。已知磺化制氨基磺酸反应原理和整个过程的流程图如下:
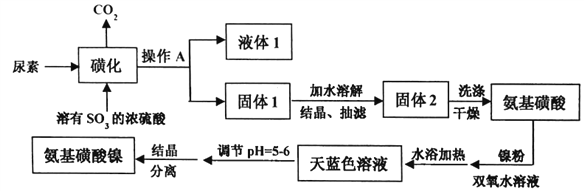
①CO(NH2)2(s)+SO3(g)→H2NCONHSO3H(s) △H<0
②H2NCONHSO3H (s)+ H2SO4→2H2NSO3H (s)+ CO2↑
已知物质的部分性质如下:
物质 | 溶解性 | 稳定性 | 酸碱性 |
氨基磺酸 | 溶于水、不溶于乙醇 | pH较低时发生水解生成NH4HSO4 | 强酸性 |
氨基磺酸镍 | 溶于水、乙醇 | 高于110℃时分解 | 酸性 |
请回答
(1)操作A的名称是_________液体1的主要成分是_______(填化学式)。
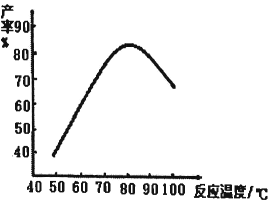
(2)“磺化”过程的温度与产率的关系如下图。温度高于80℃时氨基磺酸的产率会降低,原因一是升高温度平衡逆向移动,原因二是__________。
(3)写出制备氨基磺酸镍的化学方程式____________________。
(4)写出固体2洗涤的操作过程___________________。
(5)流程图中“天蓝色溶液”需要调节pH=5~6的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCI(浓)![]() MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。
请回答下列问题:
(1)参加反应的二氧化锰的质量为 。
(2)参加反应的HCl的物质的量为 。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3, 为使用方便,请计算出该浓盐酸的物质的量浓度: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.阿伏加德罗常数的数值与12g 12C所含的碳原子数相等
B.在0.5mol Na2SO4 中,含有的Na+ 数约是6.02×1023
C.等物质的量的O2 与O3 , 所含氧原子数相等
D.摩尔是物质的量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是抗肿瘤药物中一种关键中间体G的合成路线(部分反应条件及副产物已略去):


已知以下信息:
(1)B比A的相对分子质量大79
(2)反应④包含一系列过程,D的分子式为C2H2O3,可发生银镜反应,且具有酸性
(3)
回答下列问题:
(1)反应①和⑥的条件分别是___________、___________。
(2)下列说法不正确的是______________。
A. C物质能使三氯化铁溶液显紫色 B. D分子中含有羧基和羟基
C. E能发生氧化、加成、取代、缩聚反应 D.1molF最多可与5molH2发生加成反应
(3)反应⑤的类型是_____________________。由C 和D生成E的化学反应方程式:_________________________________。
(4)G的结构简式为_______________________。既能发生银镜反应,又含苯环的G的同分异构体有_________种。
(5) 由2分子E生成的含有3个六元环化合物中不同化学环境的氢原子共有_______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com