
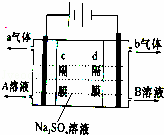
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
( )
|
| A. | c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
|
| B. | A溶液为硫酸,B溶液为氢氧化钠 |
|
| C. | a气体为氢气,b气体为氧气 |
|
| D. | 该电解反应的总方程式为:2Na2SO4+6H2O |
| 原电池和电解池的工作原理.. | |
| 专题: | 电化学专题. |
| 分析: | 根据外加电源的正负极可知有气体a生成的一极为阳极,有气体b生成的一极为阴极;阳离子透过d隔膜向阴极移动,阴离子透过c隔膜向阳极移动;根据两极上放电的离子来判断生成的气体. |
| 解答: | 解:A、根据外加电源的正负极可知有气体a生成的一极为阳极,有气体b生成的一极为阴极;阳离子透过d隔膜向阴极移动,则d隔膜为阳离子交换膜,阴离子透过c隔膜向阳极移动,c隔膜为阴离子交换膜,故A正确; B、在阳极氢氧根离子放电生成氧气,同时生成氢离子,所以阳极生成硫酸,即A溶液为硫酸;在阴极氢离子放电生成氢气,同时生成氢氧根离子,所以阴极生成NaOH,即B溶液为氢氧化钠,故B正确; C、在阳极氢氧根离子放电生成氧气,在阴极氢离子放电生成氢气,所以a气体为氧气,b气体为氢气,故C错误; D、在阳极氢氧根离子放电生成氧气,在阴极氢离子放电生成氢气,所以该电解反应的总方程式为2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑,故D正确; 故选C. |
| 点评: | 本题考查了电解池原理的应用,注意根据外加电源的正负极判断电解池的阴阳极,根据离子移动方向判断离子交换膜,注意把握题目中给出的信息,题目难度中等. |


科目:高中化学 来源: 题型:
“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④
C.②③⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是( )
|
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1,则氢气的标准燃烧热为﹣241.8 kJ•mol﹣1 |
|
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 |
|
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与能源、环境、生产、生活密切相关.下列说法不正确的是( )
|
| A. | CO2和氟氯烃等物质的大量排放会造成温室效应的加剧 |
|
| B. | 可利用工业生产产生的二氧化碳制造全降解塑料 |
|
| C. | 世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
|
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )

|
| A. | Z元素的原子半径可能比Y元素的小 |
|
| B. | W的原子序数可能是Y的原子序数的2倍 |
|
| C. | W的气态氢化物的稳定性一定比Y的强 |
|
| D. | Z的化学活泼性一定比X强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10﹣9 | 6.8×10﹣6 | 5.5×10﹣6 | 1.8×10﹣11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 不能 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 CaCO3\frac{\underline{\;高温\;}}{\;}CaO+CO2↑ .
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 可以 (填“可以”或“不可以”)得到Mg(OH)2.在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 能 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 Mg2++CO32﹣=MgCO3 MgCO3+2OH﹣=Mg(OH)2+CO32﹣ .(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10﹣3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为 10 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 漂白粉露置在空气中失效:ClO﹣+CO2+H2O=HClO+HCO3﹣ |
|
| B. | 向NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32﹣+2Cl2+3H2O=2SO32﹣+4Cl﹣+6H+ |
|
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+Fe(OH)3=FeO42﹣+3Cl﹣+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在指定条件下电离方程式正确的是 ( )
A.Na2CO3溶于水 Na2CO3===Na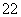 +CO
+CO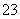
B.Al(OH)3酸式电离 Al(OH)3===H++AlO +H2O
+H2O
C.NaHS溶于水HS-的电离 HS-+H2O H2S+OH-
H2S+OH-
D.NaHCO3加热熔化 NaHCO3===Na++HCO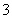
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下;下列各组离子在指定溶液中一定能大量共存的是( )。
A.0.1 mol·L-1 NaOH溶液:K+、Na+、S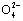 、C
、C
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、N 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、N 、I-、SCN-
、I-、SCN-
D.c(H+) /c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com