
【题目】加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)写出NaHCO3水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______NaHCO3(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。
【答案】 HCO3-+H2O![]() H2CO3+OH- > 乙 B = 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
H2CO3+OH- > 乙 B = 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
【解析】考查盐类水解,影响盐类水解的因素,(1)NaHCO3属于强碱弱酸盐,HCO3-发生水解,HCO3-+H2O![]() H2CO3+OH-;(2)根据表格数据,升高温度,pH增大,说明c(OH-)增大,即Na2CO3中CO32-的水解程度大于HCO3-;(3)①根据乙同学的说法,加热煮沸,NaHCO3分解为Na2CO3,加入BaCl2溶液,出现沉淀,说明乙的说法正确,否则甲同学说法正确,不能加入Ba(OH)2和澄清石灰水,因为它们都是强碱,OH-干扰实验;②如果大于8.3,则说明乙同学说法正确,如果等于8.3,在说明甲同学说法正确;③常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,水的沸点是100℃,因此丙同学认为乙同学错误。
H2CO3+OH-;(2)根据表格数据,升高温度,pH增大,说明c(OH-)增大,即Na2CO3中CO32-的水解程度大于HCO3-;(3)①根据乙同学的说法,加热煮沸,NaHCO3分解为Na2CO3,加入BaCl2溶液,出现沉淀,说明乙的说法正确,否则甲同学说法正确,不能加入Ba(OH)2和澄清石灰水,因为它们都是强碱,OH-干扰实验;②如果大于8.3,则说明乙同学说法正确,如果等于8.3,在说明甲同学说法正确;③常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,水的沸点是100℃,因此丙同学认为乙同学错误。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】(1)某元素的原子最外层电子排布为3s23p2,它的次外层上电子云形状有_____种,原子中所有电子占有____个轨道,核外共有____________种运动状态。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________。
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是____。
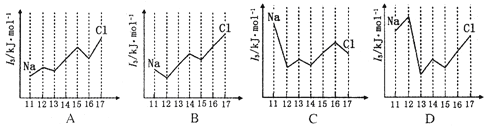
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 23g Na与氧气充分燃烧,转移的电子数为NA
B. 1mol甲醇中含有的共价键数为4NA
C. 46g NO2和N2O4的混合气体含有的原子数为2NA
D. 标准状况下,22.4L氨水含有NH3分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )

A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。

② 温度过高或过低均不利于该反应的进行,原因是________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是________。
③ 新方案的优点是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
I.有下列物质:①氢氧化钠固体 ②铝丝 ③稀硫酸 ④饱和食盐水 ⑤HCl ⑥Na2CO3.10H2O ⑦酒精 ⑧熔融的KCl ⑨明矾 ⑩石墨
属于电解质的:_______________(2)属于非电解质的:______________
(3)可导电的物质:____________________
II.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,请根据题中提供的信息,回答下列问题:
(1)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。电池放电时, 负极的电极反应式为_________,正极附近溶液的pH ______________(填“增大”,“减小”或者“不变”),充电时阳极的电极反应式为__________________,
Ni(OH)2。电池放电时, 负极的电极反应式为_________,正极附近溶液的pH ______________(填“增大”,“减小”或者“不变”),充电时阳极的电极反应式为__________________,
(2)银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中负极反应式是_______________________,正极反应式______________________,总反应式___________________________。
III..按要求写出下列方程式
明矾净水的原理(用离子方程式表示)_______________________________
盐碱地因含较多的NaCl、Na2CO3,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中使土壤碱性降低的反应化学方程式_______________________________
SOCl2是一种液态化合物,沸点77℃。向盛有10mL水的锥形瓶中,滴加8至10滴SOCl2,可观察到剧烈反应,液面上有雾形成,并有可使品红溶液褪色的气体逸出,根据实验现象,写出SOCl2与水反应的化学方程式_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验基本操作或说法正确的是 (填写序号)。
A.金属钠着火时使用泡沫灭火器灭火
B.为了有效地除去粗盐中的Ca2+、Mg2+、![]() ,可先加入NaOH,再加入BaCl2,最后加入Na2CO3,将沉淀过滤后,再用HCl调整溶液至中性
,可先加入NaOH,再加入BaCl2,最后加入Na2CO3,将沉淀过滤后,再用HCl调整溶液至中性
C.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
D.稀释浓硫酸时,应将水沿器壁缓缓加入浓硫酸中,并不断用玻璃棒搅拌
E.容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响
F.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
G.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
H.用试管加热碳酸氢钠固体时使试管口竖直向上
(2)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置,底部白色沉淀,上层为无色溶液;②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。
③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
根据以上实验现象可知,该白色固体中一定含有 (填化学式,下同) ,一定不含有 ,可能含有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com