
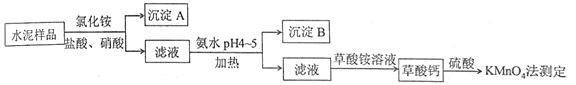
����Ŀ��ˮ������Ҫ�Ľ������ϡ�ˮ�����ϵ���Ҫ�ɷ�ΪCaO��SiO2��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��
�ش��������⣺
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᡣ���������Ŀ����__________������ʹ��___________�������ᡣ
��2������A����Ҫ�ɷ���_________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��3���Ӱ�ˮ�����м��ȵ�Ŀ����___________������B����Ҫ�ɷ�Ϊ_____________��____________���ѧʽ����
��4������Ƴ�����ϡH2SO4��������KMnO4����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ�� ![]() +H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
+H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
���𰸡� ����Ʒ�п��ܴ��ڵ�Fe2+����ΪFe3+ ˫��ˮ(H2O2) SiO2 (��H2SiO3) SiO2+4HF![]() SiF4��+2H2O ��ֹ�������ɣ��׳������� Fe(OH)3
SiF4��+2H2O ��ֹ�������ɣ��׳������� Fe(OH)3 ![]() (OH)3 45.0%
(OH)3 45.0%
����������1������������Ϣ��ˮ���к���һ��������������þ�Ƚ������������������Ҫ��ȥ��Щ���ʣ���Ϊ Fe3+������pH��Сʱ�������������ʽ������������˼��������Ŀ���ǽ���Ʒ�п��ܴ��ڵ�Fe2��ת����Fe3���� ���������Ҫ���������ԣ�ͬʱ���������µ����ʣ���Ϊ�������ⱻ��Ϊ��ɫ�����������Կ���ѡ��˫��ˮ��
��2������ˮ���гɷ֣��������費����һ������Һ�����Գ���A�Ƕ������裻 SiO2��������ᣬ�����ķ�Ӧ�ǣ�SiO2+4HF![]() SiF4��+2H2O
SiF4��+2H2O
��3������ˮ�������ȷ�Ӧ�����ȿ��Դٽ�Fe3+��Al3+ˮ��ת��ΪFe(OH)3��![]() (OH)3����������ͼ��pH4��5ʱCa2+��Mg2+��������Fe3+��Al3+���������Գ���BΪFe(OH)3��
(OH)3����������ͼ��pH4��5ʱCa2+��Mg2+��������Fe3+��Al3+���������Գ���BΪFe(OH)3��![]() (OH)3��
(OH)3��
��4������ƵĻ�ѧʽΪCaC2O4��MnO4���������������ϼ۽���5�ۣ�H2C2O4�е�C���ϼ��ɣ�3�ۡ���4�ۣ���������2�ۣ���С������Ϊ10�� ���MnO4����ϵ��Ϊ2��H2C2O4��ϵ��Ϊ5�����ù�ϵʽ��5Ca2+��5H2C2O4��2KMnO4
n(KMnO4)=0.0500mol/L��36.00��10��3mL=1.80��10��3mol
n(Ca2+)=4.50��10��3mol
ˮ���иƵ���������Ϊ4.50��10��3mol��40.0g/mol/0.400g��100%=45.0%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ���л��������м��塣��A�Ʊ�G��һ�ֺϳ�·�����£�

�ش��������⣺
(1)F�еĹ���������Ϊ______��
(2)B�ķ���ʽΪC9H8O��д��B�Ľṹ��ʽ��______��
(3)��Ӧ��~��������ȡ����Ӧ����______(�����)��
(4)д��ͬʱ��������������C��һ��ͬ���칹��Ľṹ��ʽ��______��
���ܷ���������Ӧ�� �����к��б�������4�ֲ�ͬ��ѧ�������⡣
(5)��д����![]() ��CH3C��CHΪԭ���Ʊ�
��CH3C��CHΪԭ���Ʊ� �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)______��
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��CO(g)��CuO(s)![]() CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
A. ��Ӧ�ٵ�ƽ�ⳣ��K1��c(CO2).c(Cu)/c(CO).c(CuO)
B. ��Ӧ�۵�ƽ�ⳣ��K��K1/K2
C. ���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�Ӧ���ʱ�Ϊ��ֵ
D. ���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ż�����Ⱦ�ļ��غ����ǻ�����ʶ�ļ�ǿ�����オ��������ܵ������ǵĹ�ע��������PBA (�������オ������߷��Ӳ��ϣ��ĺϳ�·�ߣ�
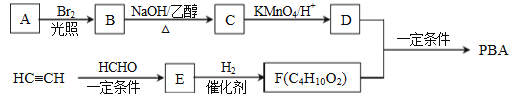
��֪������A����Է�������Ϊ84���˴Ź���������ʾֻ��1��壬����ʹ������Ȼ�̼��Һ��ɫ��
�ڻ�����C��ֻ��һ�������š�
��R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
��
(1)��A����B�ķ�Ӧ����Ϊ_________��
(2)��B����C�Ļ�ѧ����ʽΪ__________��
(3)E�Ľṹ��ʽΪ______________________��
(4)F������Ϊ______________(��ϵͳ������)����D������PBA�Ļ�ѧ����ʽΪ_______________����PBA��ƽ���ۺ϶�Ϊ70������ƽ����Է�������Ϊ___________��
(5)E��ͬ���칹������ͬʱ�������������Ĺ���_____�֣����������칹����
����״������ ���ܷ���������Ӧ ����ԭ�Ӳ���̼̼˫��ֱ������
���У��˴Ź���������ʾΪ2��壬�ҷ������Ϊ2:1����_________(д�ṹ��ʽ)��
(6)����1.3������ϩΪԭ�ϣ��������Լ���ѡ��ͨ�������Ʊ�������F����ϳ�·��Ϊ:___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I������������H2C2O4��ʾ��Ϊ�˲ⶨij������Һ��Ũ�ȣ���������ʵ�飺��ȡWg���ᾧ�壬���100.00mLˮ��Һ��ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��ΪamolL��1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��1��ʵ���У���ҺKMnO4��ҺӦװ��_____ʽ�ζ����У���Ϊ______________��
��2��ʵ�����۾�ע��_____________________��ֱ���ζ��յ㣮�жϵ����յ��������_________��
��3��ʵ���У����в�����������������ȷ��������������Ũ����ʲôӰ�죿����ƫ��ƫС����Ӱ�죩
A���ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶�_________��
B����ƿ��ʢ�Ŵ���Һǰδ�������������ˮ_________��
C���ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ����_________��
��II����50mL 0.50mol/L������50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
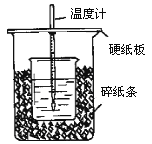
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��_________��
��2���ձ���������ֽ����������_________________________________��
��3�����ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��___________�����������һλС����
��� | ��ʼ�¶�t1�� | ��ֹ�¶�t2�� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����

A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2��+2e-= Cu
C. ����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ
D. a��b�ֱ�����ֱ����Դ������������ѹ�㹻��ʱ��Cu2����ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ԭ�ӽṹ��Ԫ�������ɵı�����ȷ����( )
A.ԭ������Ϊ15��Ԫ�ص�����ϼ�Ϊ+3
B.��A��Ԫ����ͬ�����зǽ�������ǿ��Ԫ��
C.�ڶ����ڢ�A��Ԫ�ص�ԭ�Ӻ˵������������һ��Ϊ6
D.I A��Ԫ�صĽ�����һ���Ȣ�A��Ԫ�صĽ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��100 0 mol��L��1������ζ�20��00 mLδ֪Ũ�ȵİ�ˮ���ζ�������ͼ��ʾ���μ�20��00 mL����ʱ������Һ��c(Cl��)��c(NH4+)+c(NH3��H2O)+c(NH3)������˵���������
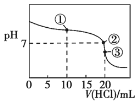
A. �ð�ˮ��Ũ��Ϊ0��100 0 mol��L��1
B. �����Һ��c(NH4+)+c(NH3��H2O)+c(NH3)��2c(Cl��)
C. �����Һ��c(NH4+)��c(Cl��)
D. �����Һ��c(Cl��)>c(H+)>c(NH4+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V1mL1.00mol��L-1HCl��Һ��V2mLδ��Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1+V2=50mL)������������ȷ���ǣ� ��
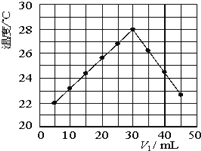
A. ����ʵ��ʱ�����¶�Ϊ22�� B. ��ʵ�������ѧ�ܿ���ת��Ϊ����
C. NaOH��Һ��Ũ��ԼΪ1.00mol��L-1 D. ��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com