
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═2H2O+O2↑ | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-═H2↑ | 用惰性电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碱性条件下氢氧燃料电池中,负极上氢气失电子发生氧化反应;
B.弱酸性条件下,钢铁发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子;
C.用惰性电极电解氢氧化钠溶液,阳极上氢氧根离子放电,阴极上氢离子放电;
D.用惰性电极电解稀硫酸溶液,阳极上氢氧根离子放电,阴极上氢离子放电.
解答 解:A.碱性条件下氢氧燃料电池中,负极上氢气失电子发生氧化反应,负极反应式为2H2-4e-+2OH-=2H2O,故A错误;
B.弱酸性条件下,钢铁发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子,正极反应式为O2+2H2O+4e-═4OH-,故B错误;
C.用惰性电极电解氢氧化钠溶液,阳极上氢氧根离子放电,阴极上氢离子放电,阴极反应式为2H++2e-═H2↑,故C正确;
D.用惰性电极电解稀硫酸溶液,阳极上氢氧根离子放电,阴极上氢离子放电,阳极反应式为4OH--4e-═2H2O+O2↑,故D错误;
故选C.
点评 本题考查电极反应式的书写,为高频考点,正确判断放电微粒是解本题关键,注意结合电解质溶液酸碱性书写,酸性条件下不能生成氢氧根离子,碱性条件下不能生成氢离子,易错选项是A.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2→BrCH2CH2Br | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 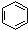 +HNO3$\stackrel{浓硫酸△}{→}$ +HNO3$\stackrel{浓硫酸△}{→}$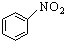 +H2O +H2O | |
| D. | C6H12O6$→_{△}^{催化剂}$2C2H5OH+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里的压强不随时间的变化而改变 | |
| B. | 单位时间内生成2mol HBr的同时,消耗1 mol H2 | |
| C. | 单位时间内生成2mol HBr的同时,生成1 mol H2 | |
| D. | 正反应和逆反应速率都相等,都等于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的△H>0,△S<0 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g),△H=-38.6 kJ•mol-1 | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
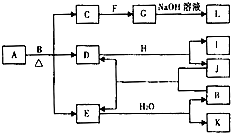 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com