
| A. | 原子半径X>Y>Z | |
| B. | 最高价氧化物的水化物酸性从强到弱的顺序是HXO4>H2YO4>H3ZO4 | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 阴离子的氧化性按Z、Y、X顺序由强到弱 |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强,同周期的X、Y、Z三种元素,已知非金属性X>Y>Z,则原子序数X>Y>Z.
A.同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其简单阴离子的还原性越弱.
解答 解:同一周期元素,元素的非金属性随着原子序数增大而增强,同周期的X、Y、Z三种元素,已知非金属性X>Y>Z,则原子序数X>Y>Z.
A.同一周期元素,原子半径随着原子序数增大而减小,则原子半径X<Y<Z,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以最高价氧化物的水化物酸性从强到弱的顺序是HXO4>H2YO4>H3ZO4,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,所以氢化物的稳定性X>Y>Z,故C错误;
D.元素的非金属性越强,其简单阴离子的还原性越弱,所以其简单阴离子的还原性强弱顺序是Z>Y>X,阴离子没有氧化性,故D错误;
故选B.
点评 本题考查元素周期律,为高频考点,明确非金属元素非金属性强弱判断方法、非金属性与其最高价氧化物的水化物酸性和氢化物的稳定性及单质的氧化性关系是解本题关键,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
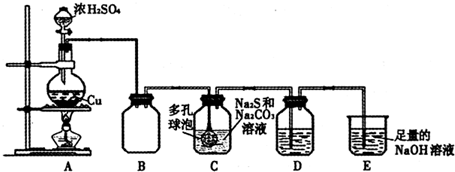
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
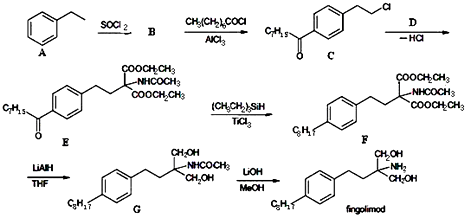
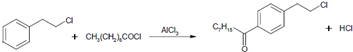 .
. .
.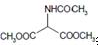 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: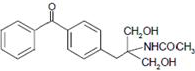 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: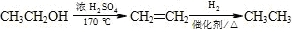
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为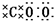 | |
| B. | 所有的主族元素的简单离子的化合价与其族序数相等 | |
| C. | NH4Cl晶体中,既含有离子键,又含有共价键 | |
| D. | 下列物质均为极性分子:H2O、NH3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: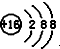 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | O-18原子的符号:${\;}_{8}^{18}$O | |
| D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 将铁片改为镁条 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y不能置换出硫酸铜溶液中的铜元素 | |
| B. | X和Y形成的化合物的化学式可以为Y3X | |
| C. | X的单质与Y的单质不能反应 | |
| D. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com