
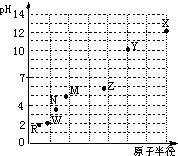
 第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A、气态氢化物的稳定性:N>R | B、Z的最高价氧化物对应的水化物能溶于稀氨水 | C、Y和R形成的化合物既含离子键又含共价键 | D、X和M两者最高价氧化物对应的水化物反应后溶液的pH>7 |


科目:高中化学 来源: 题型:
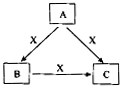 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答: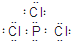
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见非金属元素,将A、C的水
溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为 。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e![]() 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________![]() 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
查看答案和解析>>
科目:高中化学 来源:2011届重庆市重庆八中高三年级第四次月考理综化学部分 题型:填空题
(15分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见非金属元素,将A、C的水
溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为 。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市高三年级第四次月考理综化学部分 题型:填空题
(15分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:

(1)若A、B、C中均含同一种常见非金属元素,将A、C的水
溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为 。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com