
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: A.Fe2+→Fe3+中,Fe元素的化合价升高;
B.失电子难的原子不一定难得到电子;
C.得到电子的多少与氧化性无关;
D.处于中间价态的微粒有氧化性,也有还原性.
解答: 解:A.Fe2+→Fe3+中,Fe元素的化合价升高,则需要加氧化剂可实现,故A正确;
B.失电子难的原子不一定难得到电子,如稀有气体难失去也难得电子,故B错误;
C.得到电子的多少与氧化性无关,得到电子的难易程度与氧化性有关,故C错误;
D.处于中间价态的微粒有氧化性,也有还原性,如亚铁离子、亚硫酸根离子,故D错误;
故选A.
点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,选项C为解答的难点,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水
中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所
得废水主要含________,可用于浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
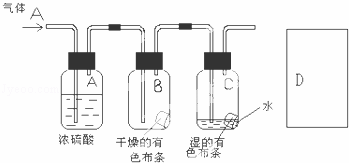
回答下列氯气的相关问题:
(1)将紫色石蕊试液滴入新制的氯水,现象是 ,起作用的微粒是 .
(2)某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓硫酸的作用是 .与研究目的直接相关的实验现象是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 .请在图D处以图的形式表明克服事故隐患的措施,写出化学方程式 .
(3)漂白粉是用Cl2与石灰乳反应来制取的,制取反应的化学方程式为 .漂白粉在空气中保存不当能失效,请用方程式表示原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. CaCl2在熔融状态下可导电,它是强电解质
B. 没有单质参加的化合反应一定是非氧化还原反应
C. 元素处于最高价态时一定具有强氧化性
D. 在2KClO3+4HCl(浓)═2KCl+2ClO2+Cl2+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实不能用同一原理解释的是()
A. 浓硝酸和氯水用棕色试剂瓶保存
B. 硫化钠和亚硫酸钠固体长期暴露在空气中变质
C. 常温下铁和铂都不溶于浓硝酸
D. SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是()
A. 将FeCl3稀溶液加热蒸发浓缩制备FeCl3的浓溶液
B. 做氢气还原氧化铜的实验是,应先通氢气后加热氧化铜
C. 稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
D. 配制1 mol•L﹣1350mLNaCl溶液可以选择一个100mL的容量瓶和一个250 mL的容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com