
分析 (1)Fe2O3是主氧化剂,与Na发生置换反应,则还原产物为Fe;
(2)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键;
(3)碳酸氢钠分解生成碳酸钠、二氧化碳与水;
(4)根据n=$\frac{V}{{V}_{m}}$计算氮气的物质的量,根据氮元素守恒计算n(NaN3),在根据m=nM计算m(NaN3),进而计算NaN3的质量分数.
解答 解:(1)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe,
故答案为:Fe;
(2)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键;
故答案为:离子键、共价键;
(3)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)碱石灰可以吸收二氧化碳、水蒸汽,剩余的气体为氮气,氮气的物质的量=$\frac{16.8L}{22.4L/mol}$=0.75mol,根据氮元素守恒n(NaN3)=$\frac{0.75mol×2}{3}$=0.5mol,
则m(NaN3)=0.5mol×65g/mol=32.5g,故NaN3的质量分数为$\frac{32.5g}{56g}$×100%=58%,
故答案为:58%.
点评 本题以汽车安全气囊的产气药剂为载体,考查化学键类型、化学反应方程式的书写、化学计算等知识,属于拼合型题目,侧重对基础知识的考查,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 3体积 | B. | 4体积 | C. | 5体积 | D. | 6体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 氢氧燃料电池的负极通入的是氢气 | |
| D. | 铜在酸性环境中易发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,可用泡沫灭火器灭火 | |
| D. | 在酚酞溶液中加入过氧化钠粉末,溶液颜色会先变红后褪色,并且有气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,合成M的流程图如下:
,合成M的流程图如下:


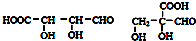 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ①③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展氢能和太阳能 | B. | 限制塑料制品的使用 | ||
| C. | 提高原子利用率,发展绿色化学 | D. | 尽量用纯液态有机物代替水作溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3molNO | |
| B. | 0.2molNO2和0.1molN2O4 | |
| C. | 0.1molNO、0.2molNO2和0.05molN2O4 | |
| D. | 0.1molNO、0.1molNO2和0.2molN2O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com