
【题目】下列指定反应的离子方程式正确的是
A. 向氨水中通入少量二氧化硫:NH3H2O+SO2═NH4++HSO3-
B. 向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. 电解氯化镁溶液:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
D. 氢氧化钡溶液中滴入硫酸氢钠溶液至Ba2+恰好完全沉淀:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。

已知:①![]()
②![]()
③![]()
请回答下列问题:
(1)下列有关F的说法正确的是_________。
A.分子式是![]() B.F即能与HCl又能与
B.F即能与HCl又能与![]() 反应生成盐
反应生成盐
C.能发生取代反应和缩聚反应 D.![]() 的F最多可以和
的F最多可以和![]() 反应
反应
(2)C→D的反应类型是________。
(3)在合成F的过程中,B→C步骤不能省略,理由是______________。
(4)D→E反应所需试剂是____________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)____。
①苯环上只有两种不同化学环境的氢原子②分子中含有![]()
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。_______________注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
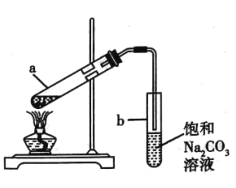
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分Ca(0H)2,含Fe203、MgO和Si02等杂质]为原料制备纳米碳酸钙的—种工艺流程如下:
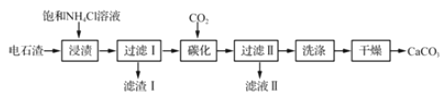
(1)电石渣溶于水形成电石渣浆时会发生反应,生成的物质中除水外还有______。
(2)“浸渍”时,NH4Cl和Ca(0H)2反应的化学方程式为______。
(3)“浸渍”时,一定时间内Ca2+浸取率随温度变化如图所示。Ca2+浸取率随温度升高而上升的原因可能是______。
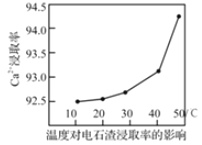
A.温度升高,增大浸取反应速率,从而提高Ca2+浸取率
B.温度升高,溶液黏稠度减小,从而提高Ca2+浸取率
C.温度升高,NH4Cl溶液水解程度减小,从而提高Ca2+浸取率
(4)“碳化”时,-般采用低温工艺,对应的离子方程式为___。
(5)滤液Ⅱ中,可循环利用的溶质的化学式为___。
(6)“洗涤”时,检验是否洗净的方法是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应 2NaCl(s) = 2Na(s)+Cl2(g)的 △H>0, △S>0
B. 常温下,将稀CH3COONa溶液加水稀释后,恢复至原温度,pH增大和Kw不变
C. 合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
D. 氢氧燃料电池工作时,若消耗标准状况下11.2LH2,则转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
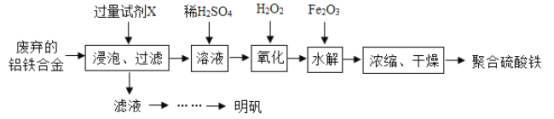
(1)室温下Ksp[Fe(OH)3]=4×l0-38制备Fe(OH)3的过程中,pH=7时溶液中c(Fe3+) =________。
(2)聚合硫酸铁是一种无瑪无窖、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①写出流程中的“氧化”时发生的离子方程式_______,浓缩时向其中加入一定量的乙醇,加入乙醇的目的是_________。
②加入试剂Y的目的是调节pH,所加试剂Y为_______;溶液pH对[Fe2(OH) x (SO4)y]n中x的值有较大影响(如图所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因:____________。
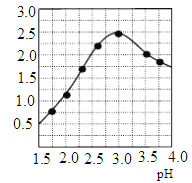
(3)明矾是一种常见铝钾硫酸盐。
①为充分利用原料,试剂X应为_______。
②请结合图所示的明矾溶解度曲线,补充完整由滤液I制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液I中加入足量的含铝废铁屑至不再有气泡产生,过滤,_____。将溶液_______、过滤、并用酒精洗涤、干燥,最终得到明矾晶体。
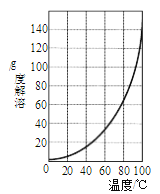
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.l00mol·L-1的NaOH溶液滴定10.00mL浓度均0.l00mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中洛液的电导率如下图所示。下列说法不正确的是( )
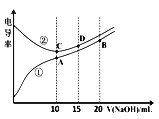
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com