
| 结构简式 | 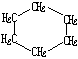 | 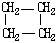 | Br-CH2-CH2-CH(CH3)-CH2-Br |
| 键线式 | 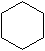 (环己烷) (环己烷) |  (环丁烷) (环丁烷) |  |

 (不需注明反应条件)
(不需注明反应条件)分析 (1)环烷烃的通式为CnH2n,和相同碳原子数的烯烃(或相对分子质量相同的烯烃)相同;
(2)根据反应①~③的反应特点结合常见的有机反应类型进行判断;根据反应条件判断反应难易程度;
(3)将两个溴原子类比氢原子与环丙烷发生加成反应判断反应产物,写出其键线式;找出二溴丙烷的其他同分异构体;
(4)烯烃能使酸性高锰酸钾褪色,烷烃则不能进行分析;
(5)某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图上只有一个峰,说明烯烃结构对称,被高锰酸钾氧化生成丙酮,烯烃为2,3-二甲基-2-丁烯.
解答 解:(1)由表中结构简式可知环烷烃的通式为CnH2n,显然与具有相同碳原子数的烯烃互为同分异构体,
故答案为:相同碳原子数的烯烃(或相对分子质量相同的烯烃);
(2)比较①~③的反应条件(温度)知,在都使用催化剂的条件下,加成反应的温度最低,故环丙烷最易发生开环加成反应,
故答案为:环丙烷;在都使用催化剂的条件下,加成反应的温度最低;
(3)根据题干加成反应的信息:环结构变为链结构,不难写出所求反应的方程式为: ,故答案为:
,故答案为: ;
;
(4)由反应④知环烷结构不与KMnO4(H+)反应,而碳碳双键易被氧化,故用酸性KMnO4溶液可将环丙烷和丙烯区别开,
故答案为:酸性高锰酸钾溶液;使酸性高锰酸钾溶液退色的是丙烯,另一种是环丙烷(或溴水,使溴水退色的是丙烯);
(5)某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图上只有一个峰,说明烯烃结构对称,被高锰酸钾氧化生成丙酮,烯烃为2,3-二甲基-2-丁烯,结构简式为C(CH3)2=C(CH3)2,
故答案为:C(CH3)2=C(CH3)2;2,3-二甲基-2-丁烯.
点评 本题综合考查有机物的性质以及结构的推断等知识,侧重考查学生有机物的鉴别知识以及根据题目信息来解决问题的能力,注意把握解题关键合理分析题中信息,得出正确结论,难度不大.


科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
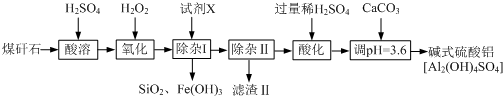
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①③④⑤ | C. | ①④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
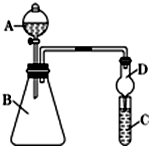 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: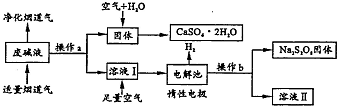
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
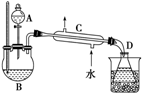 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2-O-CH2CH3(乙醚)+H2O
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2-O-CH2CH3(乙醚)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
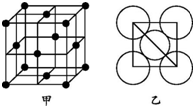 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com