
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | S2-具有还原性 | S2-能除去工业废水中的Cu2+等重金属离子 |
B | NH3具有还原性 | 蘸有浓硝酸的玻璃棒靠近浓氨水时冒白烟 |
C | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
D | SO2具有漂白性 | SO2能使紫色石蕊试液先变红后褪色 |
科目:高中化学 来源: 题型:选择题
| A. | KI和NaBr | B. | KCl和NaCl | C. | KCl和NaBr | D. | KCl、NaCl和I2 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+=3Cl2↑+3H2O,下列各微粒氧化能力强弱顺序正确的是
A.ClO3->BrO3- >IO3->Cl2 B.BrO3->Cl2>ClO3->IO3-
C.Cl2>BrO3->ClO3->IO3- D.BrO3->ClO3->Cl2>IO3-
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 浓硫酸 | 亚硫酸氢钠 | 品红试液 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
某含Na+的溶液中可能含有NH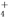 、Fe3+、Br-、CO
、Fe3+、Br-、CO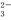 、I-、SO
、I-、SO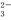 。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有( )
。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有( )
A.取样,滴加硫氰化钾溶液
B.取样,加氯水和CCl4,振荡
C.取样,加足量盐酸加热,湿润的品红试纸检验气体
D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列有关“水”的说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:填空题
写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com