

| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | ①③ |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
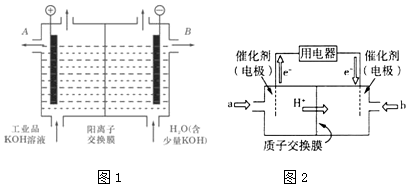
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- | |
| B. | 某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO | |
| C. | 加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ | |
| D. | 加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E |
| ①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为: 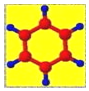 | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为: 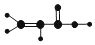 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
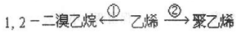
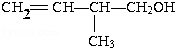
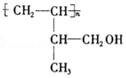 ;
;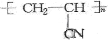 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com