

| A、元素X与元素Z的最高正化合价之和的数值等于7 |
| B、原子半径的大小顺序为:rZ>rW>rQ>rY>rX |
| C、离子Y2-和Z3+的核外电子数、电子层数和质子数都相同 |
| D、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
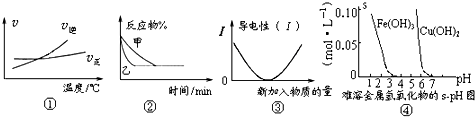
| A、根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 |
| B、图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
| C、图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D、根据图④,若要除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH=4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、MnO2作氧化剂,发生氧化反应 |
| B、在反应中,表现还原性与表现酸性的HCl的物质的量之比为2:1 |
| C、每生成1mol Cl2时,有4mol电子发生转移 |
| D、氧化性:MnO2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2 |
| B、KMnO4 |
| C、Cl2 |
| D、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 mL |
| B、50 mL |
| C、30 mL |
| D、15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1LpH=12的Ca(OH)2溶液中含阴离子0.02NA |
| B、标准状况下,NA个己烷分子所占的体积约为22.4 L |
| C、0.1mol氯气与足量的金属铁反应,转移的电子总数为0.3NA |
| D、20g重水(2H216O)含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com