
 .
.分析 (1)乙炔和HCl发生加成反应生成CH2=CHCl,CH2=CHCl发生加聚反应生成聚氯乙烯;
(2)由乙烯为平面结构可知,乙烯中4个H被甲基取代后所有C原子共面;由乙炔为直线结构可知,乙炔中H被甲基取代后所有C原子共直线;
(3)该烃只能由一种结构的炔烃加氢得到,根据烷烃的通式及分子中含有的电子数确定分子式,再根据其对应的炔烃只有1种结构写出其结构简式.
解答 解:(1)乙炔和HCl发生加成反应生成CH2=CHCl,CH2=CHCl发生加聚反应生成聚氯乙烯,反应方程式分别为CH≡CH+HCl→CH2=CHCl、 ,
,
故答案为:CH≡CH+HCl→CH2=CHCl; ;
;
(2)由乙烯为平面结构可知,乙烯中4个H被甲基取代后所有C原子共面,则C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为(CH3)2C=C(CH3)2;由乙炔为直线结构可知,乙炔中H被甲基取代后所有C原子共直线,则C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为CH3C≡CCH3,
故答案为:(CH3)2C=C(CH3)2;CH3C≡CCH3;
(3)烷烃的通式为CnH2n+2,分子中含有的电子数=6n+2n+2=50,n=6,该烷烃只能由一种结构的炔烃加氢得到,分子式为:C6H14,该戊烷只能由一种结构的炔烃加氢获得,即:向该烷烃的碳架中添加碳碳三键,只有一种添法,满足条件的烷烃的结构简式为:CH3CH2C(CH3)3或CH3CH2CH(CH3)CH2CH3,
故答案为:CH3CH2C(CH3)3;CH3CH2CH(CH3)CH2CH3.
点评 本题考查有机合成、结构简式的确定等知识点,侧重考查学生对有机化学知识的综合运用、推断及知识迁移能力,明确有机物官能团及其性质关系、物质结构是解本题关键,注意乙烯、乙炔结构特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
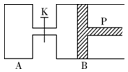 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,1L溶液中含有Cl-个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
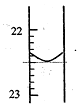 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
氨水中所含的分子和离子有 
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com