
����X��Y��Z��W���ֶ�����Ԫ�ء�
��XԪ�صĵ�����YԪ�صĵ�����ȼ�շ�����ɫ����,����������A��
��ZԪ�صĵ�����A��ˮ��Һ��Ӧ������XԪ�صĵ��ʡ�
��ZԪ�ص�ԭ�Ӻ�YԪ�ص�ԭ�ӵ��Ӳ�����ͬ�������ǵ�����������֮��ľ���ֵΪ������
��WԪ�ص�ԭ�Ӻ�����3�����Ӳ㣬���������������ڵ��Ӳ�����
��ش��������⣺
��1��X��Ԫ�ط���Ϊ��_________��Z��Ԫ�������ǣ� ����2�֣�
��2��A�ĵ���ʽ�� ����2�֣�
��3��Z�ĵ�����A����Һ��Ӧ�����ӷ���ʽ ����2�֣�
��4��W������������NaOH�еĻ�ѧ����ʽ ����2�֣�
 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | X | Y | Z | W |
| ԭ�Ӱ뾶/nm | 0.186 | 0.074 | 0.102 | 0.077 |
| ��Ҫ���ϼ� | +1 | -2 | -2��+6 | -4��+4 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


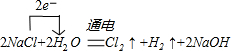
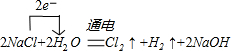
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣�����X��Y��Z��W���ֳ����ĺ����ᣬ�����Ԫ�ط������ڱ��ж����ڵĵڢ�A�嵽�� ��A�������ֺ�������Һ�ֱ���й��ջ��Ȳ���������ݣ�����QΪ��ȷ�������ʣ���
| ������ | X | Y | Z | W |
| ����������/g | 25��2 | a | 3��1 | 10��5 |
| ������U/g | 3��2 | / | / | 3��2 |
| ������V/g | 3��6 | 0��9 | 0��9 | / |
| ������Q/g | 18��4 | 3��2 | b | c |
������ѧ��ѧ֪ʶ�ش��������⣺
��1���ϱ��к��������ƣ�Z ��W �����������ƣ�U ��V ��
��2���ϱ������ݣ�aΪ ��bΪ ��cΪ ��
��3����X��ϡ��Һ����Y�У���Ӧ�����ӷ���ʽ�� ��
��4����W��ˮ��Һ����һ��ʱ�����Һ��pH �����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��֣���и߶���ѧ����ĩ���Ի�ѧ���� ���ͣ������
����X��Y��Z��W���ֶ�����Ԫ�ء�
��XԪ�صĵ�����YԪ�صĵ�����ȼ�շ�����ɫ����,����������A��
��ZԪ�صĵ�����A��ˮ��Һ��Ӧ������XԪ�صĵ��ʡ�
��ZԪ�ص�ԭ�Ӻ�YԪ�ص�ԭ�ӵ��Ӳ�����ͬ�������ǵ�����������֮��ľ���ֵΪ������
��WԪ�ص�ԭ�Ӻ�����3�����Ӳ㣬���������������ڵ��Ӳ�����
��ش��������⣺
��1��X��Ԫ�ط���Ϊ��_________��Z��Ԫ�������ǣ� ����2�֣�
��2��A�ĵ���ʽ�� ����2�֣�
��3��Z�ĵ�����A����Һ��Ӧ�����ӷ���ʽ ����2�֣�
��4��W������������NaOH�еĻ�ѧ����ʽ ����2�֣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com