
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
分析 化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应可自发进行,以此解答该题.
解答 解:A.铁在潮湿空气中生锈,发生电化学腐蚀,为自发进行的反应,故A正确;
B.放热反应不一定自发进行,如铝热反应需要在高温下才能进行,而常温下不反应,故B正确;
C.化学反应能否自发进行,取决于焓变和熵变的综合判据,自发进行的反应,熵不一定增大,故C错误;
D.电解池的反应是外加电源的反应,将电能转化为化学能,如断开电路,则反应不能自发进行,故D正确.
故选C.
点评 本题考查反应热与焓变,为高频考点,侧重于基本理论知识的综合理解和运用的考查,注意反应能否自发进行与焓变和熵变的关系,易错点为D,注意电解池的反应不是自发过程,题目难度不大.


科目:高中化学 来源: 题型:选择题
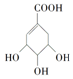 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )| A. | 该有机物能使溴的四氯化碳溶液褪色 | |
| B. | 该有机物发生消去反应可得到芳香烃 | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 1 mol该有机物最多可与1 mol NaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
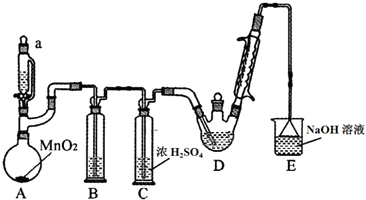
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)
200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)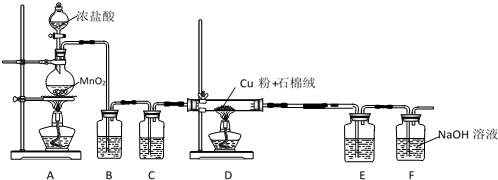
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
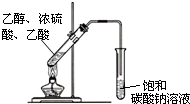 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯查看答案和解析>>
科目:高中化学 来源: 题型:实验题
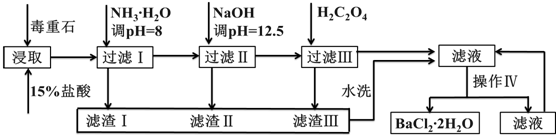
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com