
【题目】亚硝酸钙[Ca(NO2)2]是易溶于水的无色晶体,可用作水泥硬化促进剂和防冻阻锈剂等。实验室可通过反应Ca(NO3)2+CaFe2O4+NO→Ca(NO2)2+Fe2O3(未配平)制备高纯度的亚硝酸钙,装置如图所示:
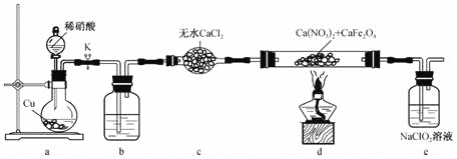
下列说法错误的是( )
A.装置b中盛放的试剂为浓硫酸 B.向烧瓶中加入稀硝酸前需打开K
C.装置e主要用于除去尾气中的NO D.d中每生成1 mol Ca(NO2)2,转移 ![]() mol电子
mol电子
【答案】A
【解析】
A.装置a、b、c是用于制取纯净干燥的NO,由于NO易被空气中的O2氧化成NO2 , 因此装置b中的试剂应为H2O,利用NO2与H2O反应生成NO,装置c中的无水CaCl2用于干燥NO,故A错误;
B.向烧瓶中加入稀硝酸后,即发生反应生成NO,为使NO顺利排出,应先打开K,故B正确;
C.NaClO3溶液具有氧化性,能将NO氧化吸收,因此装置e是用于除去尾气中的NO,故C正确;
D.反应过程中,Ca(NO3)2中氮元素由+5价变为+3价,NO中氮元素由+2价变为+3价,其余元素的化合价均不发生变化,结合得失电子守恒和原子守恒可得该反应的化学方程式为:Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3, 因此每生成3molCa(NO2)2转移4mol电子,则每生成1molCa(NO2)2转移
3Ca(NO2)2+2Fe2O3, 因此每生成3molCa(NO2)2转移4mol电子,则每生成1molCa(NO2)2转移![]() mol电子,故D正确;
mol电子,故D正确;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是

A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于NO、NO2的问题:
(1)汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
(2)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
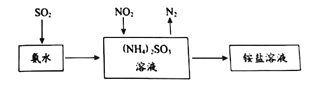
NO2被吸收后生成的铵盐是____________(填化学式);为证明溶液中NH4+的存在,可向少量铵盐溶液中加入___________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
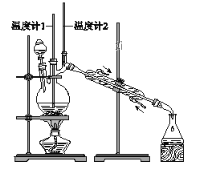
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是
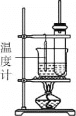
A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示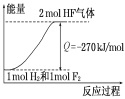
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解NaOH溶液即电解水:2H2O![]() 2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
(1)在阴极产生的氢气的体积(按标准状况计)为______
(2)阳极产生的氧气的物质的量为__________
(3)假定控制条件使Cl2未从电解液中逸出,电解结束后经充分搅拌Cl2与NaOH发生了完全反应,生成NaClO和部分NaClO3。求完全反应后电解池中三种钠盐的总质量____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com