
| A、在标准状况下,将22.4L氨气溶于1L水中,得到1mol?L-1的氨水 |
| B、配制0.1mol?L-1的Na2CO3溶液480mL,需用500mL容量瓶 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和则加入的Na2O2与Na2O的物质的量之比等于1:1(温度不变) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、太阳能、核能和天然气都属于新型能源 |
| B、哥本哈根气候大会讨论的减排目标主要是控制二氧化硫排放 |
| C、84消毒液具有强氧化性,可杀死流感病毒 |
| D、比黄金还贵的18O2和普通的16O2是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体的热稳定性:Na2CO3>CaCO3>NaHCO3 |
| B、金属活动性Li>Na>K |
| C、氧化物的稳定性:H2Se>H2S |
| D、微粒半径:K+>S2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O2与18O2互为同位素,H2O、D2O、T2O互为同素异形体,N60和N2互为同系物 |
| B、除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| C、非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 |
D、Ca的原子结构示意图为 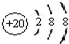 |
查看答案和解析>>
科目:高中化学 来源: 题型:
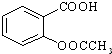 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: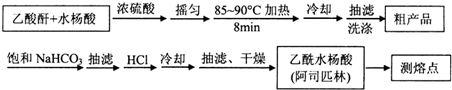
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
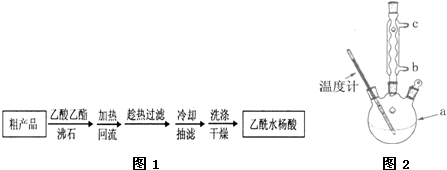
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com