

| A����Ӧ���ʣ�v��B����v��A�� |
| B��A ������X��ת����Ϊ80% |
| C������K����A�������Ϊ2.6a L |
| D��ƽ��ʱY�����������A��B |
| 8.4mol |
| 2mol |


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д� ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��V1 mL 1.00mol?L-1 HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL��������������ȷ���ǣ�������
��V1 mL 1.00mol?L-1 HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL��������������ȷ���ǣ�������| A������ʵ��ʱ�����¶�Ϊ22�� |
| B����ʵ��������л�ѧ��Ӧ��ѧ��ֻת��Ϊ���� |
| C��NaOH��Һ��Ũ��Ϊ1.50 mol?L-1 |
| D����ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��+16.3 kJ/mol |
| B��-16.3 kJ/mol |
| C��+335.7 kJ/mol |
| D��-335.7 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
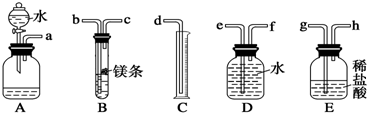
| A����װ��ҩƷ������װ�õ������� |
| B������˫���ս��Թܣ����ܲ���ˮ���Լ��װ�õ������� |
| C����ʼ������ԭ����ͭ��ʵ��ʱ����ͨ��һ��ʱ����������ټ��� |
| D��ϡ������ʱ�������ձ��ﵹ��ˮ����С������Ũ���Ტ���Ͻ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com