
从废液FeCl3、FeCl2、CuCl2中回收Cu,同学们设计了如下方案:废液中加入过量的铁粉,过滤,向铁、铜混合物中加入足量的盐酸,过滤后得到铜。上述过程中发生的所有反应的离子方程式为: 这些反应所涉及的四种阳离子的氧化性顺序由大到小为
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
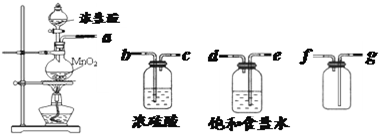
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液色 不褪色 |
固体物质中不含______ |
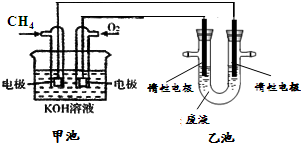
查看答案和解析>>
科目:高中化学 来源: 题型:
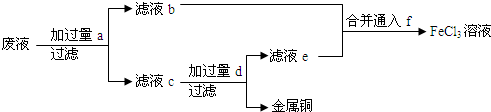
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com