
| A. | Na+、Fe3+是人体所需微量元素 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 氢气是未来的一种理想燃料 | D. | 乙醇是不可再生的生物质能源 |
分析 A.Na不是微量元素;
B.苯酚可使蛋白质变性;
C.氢气燃烧产物为水;
D.乙醇可由淀粉和纤维素制取.
解答 解:A.人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒,Na不是微量元素,故A错误;
B.苯酚可使蛋白质变性,可用于杀菌消毒,故B错误;
C.氢气燃烧产物为水,对环境无污染,为清洁燃料,故C正确;
D.乙醇可由淀粉和纤维素制取,乙醇是可再生的生物质能源,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为高频考点,题目侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5517.6kJ•mol-1 | |
| C. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
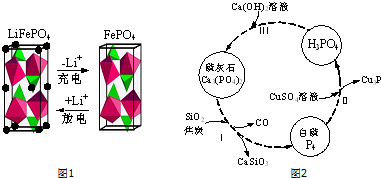
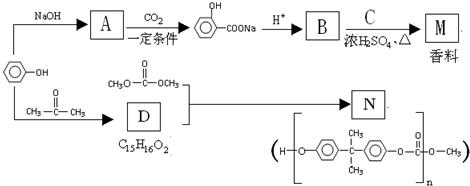
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
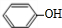 +NaOH→
+NaOH→ +H2O.
+H2O. ;
;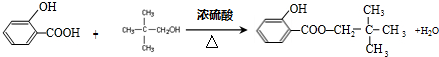 .
.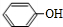 +
+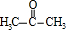 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$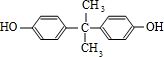 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应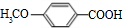 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 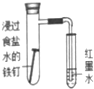 | 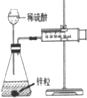 | 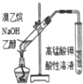 | 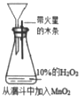 |
| 现象 | 导管中有红色柱 | 注射器的活塞往外推 | 高锰酸钾酸性溶液褪色 | 带火星的木条复燃 |
| 结论或作用 | 证明铁钉发生吸氧腐蚀 | 可用于测定反应物浓度对反应速率的影响 | 溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯 | MnO2可与H2O2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
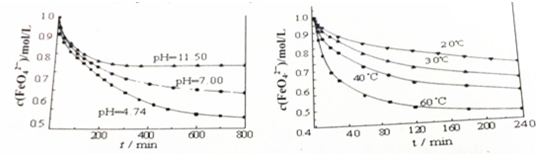
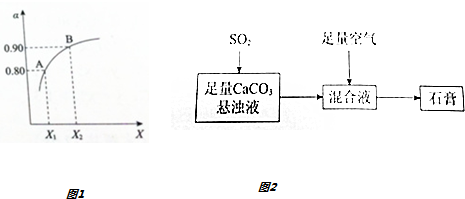
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com