
| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
分析 A.主族元素最高正化合价等于其族序数(O、F元素除外);
B.ⅡA族元素单质都呈银白色金属;
C.ⅡA族元素均为金属元素,性质活泼,在自然界中没有游离态的单质;
D.Mg元素被誉为“国防金属”的元素.
解答 解:A.主族元素最高正化合价等于其族序数(O、F元素除外),ⅡA族元素的主要化合价都是+2价,故A正确;
B.ⅡA族元素单质都呈银白色金属,故B正确;
C.ⅡA族元素均为金属元素,性质活泼,在自然界中没有游离态的单质,故C错误;
D.ⅡA族中Mg元素被誉为“国防金属”的元素,故D正确,
故选C.
点评 本题考查同一主族元素元素性质递变性与相似性,比较基础,注意对基础知识的理解掌握.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
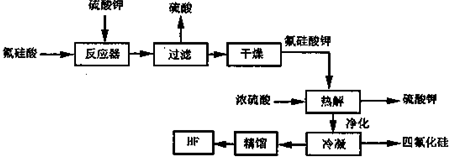
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
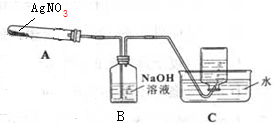
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com