
| A、x=1 |
| B、2min内A的反应速率为0.3mol?L-1?min-1 |
| C、B的转化率为50% |
| D、若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态 |
| ||
| △t |
| ||
| 2min |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 0.4mol |
| 1mol |


科目:高中化学 来源: 题型:
| A、标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA |
| B、将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L |
| C、在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当a为电流表,b为浓硝酸时:Y为负极 |
| B、当a为电流表,b为稀硫酸时:X电极反应为:Fe-2e-=Fe2+ |
| C、当a为直流电源,b为CuSO4溶液时:X、Y两电极附近的 SO42-浓度相等 |
| D、当a为直流电源,b为NaOH溶液,X极附近产生白色沉淀时:电子从X极流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
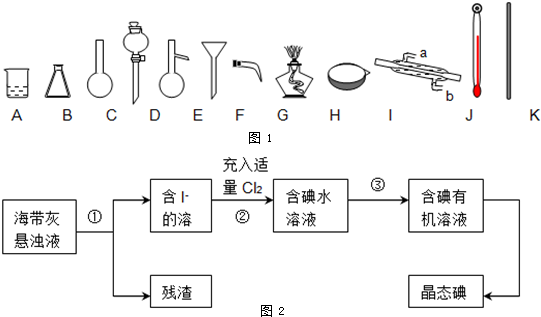
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.33×10-4 |
| B、1×10-5 |
| C、1×10-10 |
| D、1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
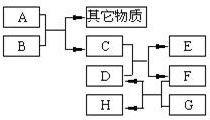 已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com