
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪµŻŌö”£ŅŃÖŖ£ŗ
¢ŁFµÄŌ×ÓŠņŹżĪŖ29£¬ĘäÓą¾łĪŖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£»
¢ŚAµÄÄŚ²ćµē×Ó×ÜŹżŹĒ×īĶā²ćµē×ÓŹżµÄŅ»°ė£»
¢ŪC”¢EĶ¬Ö÷×åĒŅCŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£»
¢ÜDŹĒ½šŹōŠŌ×īĒæµÄ¶ĢÖÜĘŚŌŖĖŲ”£Ķź³ÉĻĀĮŠĪŹĢā
£Ø1£©FŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆ______________”£
£Ø2£©B”¢C”¢D”¢EµÄŌ×Ó°ė¾¶ÓÉŠ”µ½“óĖ³ŠņŹĒ_________ £ØÓĆŌŖĖŲ·ūŗűķŹ¾£©”£
£Ø3£©ŅŃÖŖDŌŚCµÄµ„ÖŹÖŠČ¼ÉÕÉś³Éµ»ĘÉ«µÄ¹ĢĢå»ÆŗĻĪļ¼×£¬¼×µÄ»ÆѧŹ½ĪŖ_______________£¬µē×ÓŹ½ĪŖ_______£¬¼×ÖŠµÄ»Æѧ¼üĄąŠĶĪŖ____________________”£
£Ø4£©AµÄµ„ÖŹÓėEµÄ×īøß¼Ūŗ¬ŃõĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
”¾“š°ø”æ£Ø1£©µŚĖÄÖÜĘŚ¢ńB×å
£Ø2£©O£¼N£¼S£¼Na
£Ø3£©Na2O2![]() ¹²¼Ū¼üŗĶĄė×Ó¼ü£Ø»ņ·Ē¼«ŠŌ¹²¼Ū¼üŗĶĄė×Ó¼ü£©
¹²¼Ū¼üŗĶĄė×Ó¼ü£Ø»ņ·Ē¼«ŠŌ¹²¼Ū¼üŗĶĄė×Ó¼ü£©
£Ø4£©C£«2H2SO4£ØÅØ£©![]() CO2”ü£«2SO2”ü£«2H2O
CO2”ü£«2SO2”ü£«2H2O
”¾½āĪö”æŹŌĢā·ÖĪö£ŗFµÄŌ×ÓŠņŹżĪŖ29£¬ŌņFĪŖCuŌŖĖŲ£»AµÄÄŚ²ćµē×Ó×ÜŹżŹĒ×īĶā²ćµē×ÓŹżµÄŅ»°ė£¬æÉÖŖAĪŖĢ¼ŌŖĖŲ£»C”¢EĶ¬Ö÷×åĒŅCŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£¬ŌņCĪŖŃõŌŖĖŲ£¬EĪŖĮņŌŖĖŲ£¬²¢æÉÖŖBĪŖµŖŌŖĖŲ£»DŹĒ½šŹōŠŌ×īĒæµÄ¶ĢÖÜĘŚŌŖĖŲ£¬æÉÖŖDĪŖÄĘŌŖĖŲ£»
£Ø1£©ĶŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆĪŖµŚĖÄÖÜĘŚ¢ńB×唣
£Ø2£©Ķ¬ÖÜĘŚÖ÷×åŌŖĖŲŗĖµēŗÉŹżŌ½“ó£¬Ō×Ó°ė¾¶Ō½Š”£¬ŌņN”¢O”¢Na”¢SµÄŌ×Ó°ė¾¶ÓÉŠ”µ½“óĖ³ŠņŹĒO£¼N£¼S£¼Na”£
£Ø3£©NaŌŚŃõĘųÖŠČ¼ÉÕÉś³Éµ»ĘÉ«µÄ¹ĢĢåNa2O2£¬Ęäµē×ÓŹ½ĪŖ![]() £¬ŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĪŖ¹²¼Ū¼üŗĶĄė×Ó¼ü”£
£¬ŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĪŖ¹²¼Ū¼üŗĶĄė×Ó¼ü”£
£Ø4£©CÓėÅØĮņĖį»ģŗĻ¼ÓČČ£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖC£«2H2SO4£ØÅØ£©A”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪµŻŌö”£ŅŃÖŖ£ŗ
¢ŁFµÄŌ×ÓŠņŹżĪŖ29£¬ĘäÓą¾łĪŖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£»
¢ŚAµÄÄŚ²ćµē×Ó×ÜŹżŹĒ×īĶā²ćµē×ÓŹżµÄŅ»°ė£»
¢ŪC”¢EĶ¬Ö÷×åĒŅCŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£»
¢ÜDŹĒ½šŹōŠŌ×īĒæµÄ¶ĢÖÜĘŚŌŖĖŲ”£Ķź³ÉĻĀĮŠĪŹĢā
£Ø1£©FŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆ______________”£
£Ø2£©B”¢C”¢D”¢EµÄŌ×Ó°ė¾¶ÓÉŠ”µ½“óĖ³ŠņŹĒ_________ £ØÓĆŌŖĖŲ·ūŗűķŹ¾£©”£
£Ø3£©ŅŃÖŖDŌŚCµÄµ„ÖŹÖŠČ¼ÉÕÉś³Éµ»ĘÉ«µÄ¹ĢĢå»ÆŗĻĪļ¼×£¬¼×µÄ»ÆѧŹ½ĪŖ_______________£¬µē×ÓŹ½ĪŖ_______£¬¼×ÖŠµÄ»Æѧ¼üĄąŠĶĪŖ____________________”£
£Ø4£©AµÄµ„ÖŹÓėEµÄ×īøß¼Ūŗ¬ŃõĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
CO2”ü£«2SO2”ü£«2H2O”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ֊ѧ³£¼ū·“Ó¦µÄ»Æѧ·½³ĢŹ½ÓŠA£«B”śX£«Y£«H2O»ņH2O£«A£«B”śX£«Y£ØĪ“ÅäĘ½£¬·“Ó¦Ģõ¼žĀŌČ„£©£¬ĻĀĮŠĪŹĢāĖłÉę¼°·“Ó¦ŹĒÉĻŹöĮ½øö·½³ĢŹ½Ö®Ņ»”£Ēė»Ų“š£ŗ
£Ø1£©³£ĪĀĻĀ£¬ČōAĪŖ»ĘĀĢÉ«ĘųĢ壬BĪŖ·Ē½šŹōŃõ»ÆĪļ£¬A”¢B¾łÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬A£«B£«H2O”śX£«Y£¬ĒŅĻą¶Ō·Ö×ÓÖŹĮæX£¾Y£¬ŌņøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½________£¬¼ģŃéYÖŠŅõĄė×ӵďŌ¼ĮŹĒ__________”£
£Ø2£©ČōAĪŖ³£¼ūµÄ½šŹōµ„ÖŹ£¬YĪŖĘųĢ¬µ„ÖŹ£¬BČÜŅŗ³ŹĒæĖįŠŌ»ņĒæ¼īŠŌŹ±£¬AŗĶB·“Ó¦¶¼ÄܽųŠŠ”£Š“³öAÓėB·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ £» ”£
£Ø3£©ČōAĪŖ³£¼ūµÄ·Ē½šŹōµ„ÖŹ£¬ĖüŹĒ¹¹³ÉÓŠ»śĪļµÄ»ł±¾ŌŖĖŲÖ®Ņ»£¬BµÄČÜŅŗĪŖijÅØĖį£¬ĘäÖŠA”¢BµÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć4£¬ŌņøĆ·“Ó¦»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø4£©ČōA”¢B¾łĪŖ»ÆŗĻĪļ£¬YĪŖ°×É«³Įµķ£Ø²»ŗ¬½šŹōŌŖĖŲ£©£¬BĪŖŅżĘšĪĀŹŅŠ§Ó¦µÄÖ÷ŅŖĘųĢ壬Š“³öAÓėB·“Ӧɜ³ÉYµÄĄė×Ó·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹¤ŅÕŹōÓŚĪļĄķ¹ż³ĢµÄŹĒ£Ø £©
A£®ĆŗµÄøÉĮó B£®ĆŗµÄĘų»Æ C£®ŹÆÓĶ·ÖĮó D£®ŹÆÓĶĮŃ»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²½ÖčŹĒŠĖȤŠ”×é¶Ōij»ģŗĻѳʷŗ¬ĮæµÄ²ā¶Ø£¬ŃłĘ·³É·ÖĪŖFeO”¢FeS2”¢SiO2”¢¼°ĘäĖüŌÓÖŹ£¬ŌÓÖŹ²»ÓėĖį¼ī·“Ó¦£¬ŹÜČČĪČ¶Ø”££Ø²½ÖčÖŠĖł¼ÓŹŌ¼Į¾łĪŖ×ćĮ棩
¢Ł³ĘĮæmgѳʷ×ĘÉÕ”£×°ÖĆČēĻĀ£ŗ
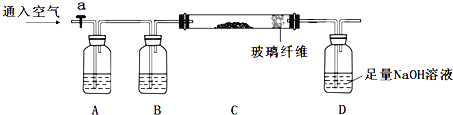
¢ŚDĘæČÜŅŗ![]()
![]()
![]() ¹ĢĢå£Øag£©
¹ĢĢå£Øag£©
¢Ū![]()
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Į¬½ÓŗĆŅĒĘ÷ŗó£¬ČēŗĪ¼ģ²éÕūĢ××°ÖƵÄĘųĆÜŠŌ_______________”£
£Ø2£©AĘæÄŚĖłŹ¢ŹŌ¼ĮŹĒ__________ČÜŅŗ”£×ĘÉÕĶź³ÉŗóĻØĆš¾Ę¾«µĘ£¬ČōĮ¢¼“Ķ£Ö¹ĶØæÕĘų£¬æÉÄܶŌŹµŃéµÄÓ°ĻģŹĒ(Š“Į½µć) _________________________”£
£Ø3£©²½Öč¢ŚÖŠ¼ÓČėĖ«ŃõĖ®µÄĄė×Ó·½³ĢŹ½ĪŖ____________________”£Čō“Ė²½Öč²»¼ÓČėĖ«ŃõĖ®¶Ō²ā¶ØĮņŌŖĖŲŗ¬ĮæµÄÓ°ĻģŹĒ_____________£ØĢī”°Ę«øß”±”¢”°Ę«µĶ”±»ņ”°ĪŽÓ°Ļģ”±£©”£
£Ø4£©Į¬Šų²Ł×÷1ĪŖ_________”¢Ļ“µÓ”¢_________”¢³ĘĮ棻Į¬Šų²Ł×÷2ĪŖĻ“µÓ”¢_________”¢³ĘĮ攣
£Ø5£©“Ó²½Öč¢ŪµÄbgĀĖŌüČėŹÖ£¬æɲā¶ØSiO2µÄŗ¬Į棬ĻĀĆęø÷×éŹŌ¼ĮÖŠ²»ŹŹŗĻ²ā¶ØµÄŹĒ___________”£
A£®NaOHČÜŅŗ ”¢Ļ”ĮņĖį B£®Ba(OH)2ČÜŅŗ”¢ŃĪĖį C£®°±Ė®”¢Ļ”ĮņĖį D£®NaOHČÜŅŗ”¢ŃĪĖį
£Ø6£©Ēóѳʷ֊FeOµÄÖŹĮæ·ÖŹż£ØĮŠ³öĖćŹ½¼“æÉ£©____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ÓĆÕżČ·µÄŠņŗÅĢīæÕ: ¢Ł12C”¢13C”¢14C£» ¢ŚŗģĮ×ŗĶ°×Į×; ¢ŪH2OŗĶD2O£»¢ÜCH3CH2OHÓėCH3OCH3£» ¢ŻCH4ŗĶCH3CH3 £»
»„ĪŖĶ¬Ī»ĖŲµÄŹĒ £» »„ĪŖĶ¬ĖŲŅģŠĪĢåµÄŹĒ £»
»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄŹĒ £» »„ĪŖĶ¬ĻµĪļµÄŹĒ
£Ø2£©ÓÉA”¢B”¢C”¢DĖÄÖÖ½šŹō°“ĻĀ±ķ֊װÖĆ½ųŠŠŹµŃ锣
×°ÖĆ |
|
|
|
ĻÖĻó | ½šŹōA²» ¶ĻČܽā | CµÄÖŹ ĮæŌö¼Ó | AÉĻÓŠĘų Ģå²śÉś |
øł¾ŻŹµŃéĻÖĻó»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł×°ÖĆ¼×ÖŠ×÷Õż¼«µÄŹĒ_____ ___ £ØĢī”°A”±»ņ”°B”±£©”£
¢Ś×°ÖĆŅŅČÜŅŗÖŠCu2£«Ļņ_____ __¼«ŅĘ¶Æ£ØĢī”°B”±»ņ”°C”±£©”£
¢Ū×°ÖƱūÖŠ½šŹōAÉĻµē¼«·“Ó¦ŹōÓŚ___ ___£ØĢī”°Ńõ»Æ·“Ó¦”±»ņ”°»¹Ō·“Ó¦”±£©”£
¢ÜĖÄÖÖ½šŹō»ī¶ÆŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒ____ ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠa mol/L µÄNaXŗĶb mol/LµÄNaYĮ½ÖÖŃĪČÜŅŗ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®Čōa=bĒŅc(X£)= c(Y£)+ c(HY)£¬ŌņHXĪŖĒæĖį
B£®Čōa=bĒŅpH(NaX)£¾pH(NaY),Ōņc(X£)+ c(OH£)£¾ c(Y£)+ c(OH£)
C£®Čōa£¾bĒŅc(X£)= c(Y£)£¬ŌņĖįŠŌHX£¾HY
D£®ČōĮ½ČÜŅŗµČĢå»ż»ģŗĻ£¬Ōņc(Na+)=(a+b) mol/L(ŗöĀŌ»ģŗĻ¹ż³ĢÖŠµÄĢå»ż±ä»Æ)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ±ä»ÆÖŠ£¬Šč¼ÓČėŃõ»Æ¼Į²ÅÄÜŹµĻֵďĒ£Ø £©
A£®Al£ØOH£©3”śAl2O3 B£®FeCl3”śFeCl2
C£®SO2”śSO3 D£®CuO”śCu
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ»śĪļæÉŅŌŠĪ³ÉĖ³·“Ņģ¹¹µÄŹĒ£Ø £©
A£®±ūĻ©
B£®1©ĀČ©1©±ūĻ©
C£®2©¼×»ł©2©¶”Ļ©
D£®2£¬3©¶ž¼×»ł©2©¶”Ļ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放»Æѧ”Ŗ”ŖŃ”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ”æ
X”¢Y”¢Z”¢WĪŖĒ°ĖÄÖÜĘŚŌŖĖŲĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬XµÄµē×Ó²ćŹżµČÓŚŗĖĶāµē×ÓŹż£¬YŌŖĖŲ»łĢ¬Ō×ÓŗĖĶāĪ“³É¶Ōµē×ÓŹżĪŖ2ĒŅXÓėYŠĪ³ÉµÄ»ÆŗĻĪļŌŚ³£ĪĀĻĀĪŖ³£¼ūµÄŅŗĢåR£¬ZŌŖĖŲŌ×Ó×īĶāµē×Ó²ćÉĻs”¢pµē×ÓŹżĻąµČ£¬W»łĢ¬Ō×Ó3d¹ģµĄµÄµē×ÓŹżŹĒ4s¹ģµĄµē×ÓŹżµÄ3±¶”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Y»łĢ¬Ō×ӵļŪµē×ÓÅŲ¼Ķ¼ĪŖ £¬Ę䵌Ņ»µēĄėÄÜŌŚĶ¬ÖÜĘŚŌŖĖŲÖŠÓɓ󵽊”ÅŵŚ Ī»”£
£Ø2£©WµÄŌŖĖŲĆū³ĘĪŖ £¬Ę仳Ģ¬Ō×ÓŗĖĶāÓŠ ÖÖæÕ¼äŌĖ¶ÆדĢ¬²»Ķ¬µÄµē×Ó”£
£Ø3£©RµÄÖŠŠÄŌ×Ó²ÉČ”µÄŌӻƷ½Ź½ĪŖ £¬Š“³öRµÄŅ»øöµČµē×ÓĢå£ŗ ”££ØĢī»ÆѧŹ½£©”£
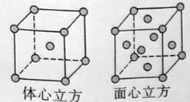
£Ø4£©ZÓėYŌŚŅ»¶ØĢõ¼žĻĀæÉŠĪ³ÉøßÓ²¶ČµÄ»ÆŗĻĪļ£¬øĆ»ÆŗĻĪļµÄ¾§ĢåĄąŠĶĪŖ £¬ĘäÓÉZ”¢Y¹¹³ÉµÄ×īŠ”»·ĪŖ ŌŖ»·”£
£Ø5£©WµÄµ„ÖŹŌŚ900”ęŅŌĻĀĪŖ¦ĮŠĶĢåŠÄĮ¢·½¾§°ū£¬910”ęŅŌÉĻW×Ŗ±äĪŖ¦ĆŠĶĆęŠÄĮ¢·½¾§°ū£¬¾§°ū½į¹¹·Ö±šČēĶ¼ĖłŹ¾”£Į½ÖÖ¾§ĢåÖŠ¾ąĄė×ī½üµÄĢśŌ×Ó¼ä¾ąĄėĻąĶ¬”£ŌņŌŚ800”ęŗĶ1000”ęĻĀ£¬ĢśµÄĆܶČÖ®±ČĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com