
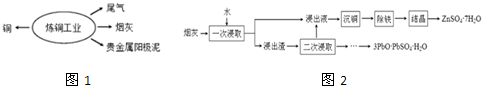
分析 流程图2整体分析如下:烟灰加入水,浸出液中含Cu2+,加入锌粉(或铁粉),置换出铜(沉铜),溶液中为ZnSO4、FeSO4再加入碱使铁元素沉淀并分离出去(除铁),结晶可得到ZnSO4.7H2O,
(1)根据物质的性质,分析可发生反应的物质和产品之间的关系,写出相关反应;
(2)①根据流程图,分析“沉铜”前后,铜元素发生的变化,找出恰当的物质;
②根据铜的化合物的溶解性回答;
(3)根据“阳氧阴还”,阴极发生还原反应,得电子,再结合离子放电顺序,即可得出答案;再抓住题给信息“产生的气体遇空气迅速变为红棕色”,利用守恒关系解答.
解答 解:(1)氨水中主要成分为NH3.H2O,可与酸性氧化物SO2反应生成盐与水,方程式为:SO2+2NH3.H2O=(NH4)2SO3+H2O,再加入硫酸,发生复分解反应:盐+较强酸=另一种盐+较弱的酸,方程式如下:(NH4)2SO3+H2SO4=H2O+SO2↑+(NH4)2SO4
故答案为:SO2+2NH3.H2O=(NH4)2SO3+H2O;(NH4)2SO3+H2SO4=H2O+SO2↑+(NH4)2SO4;
(2)①通过流程图可以看出,浸出液中含有能溶于水的Cu2+,沉铜则需要将其转化为单质铜,所以需要加入还原性比铜强的金属,考虑不引入其他杂质,最好加入锌粉(铁粉也可以),
故答案为:锌粉(或铁粉);
②根据流程图2看出,第一次用水浸取,可浸出能溶于水的化合物,不溶于水的CuO则在浸出渣中,所以要提高浸出率,应选能溶解CuO的酸,结合流程图,选用的是硫酸,
故答案为:CuO;H2SO4;
(3)阴极得电子,发生还原反应,所以为:Ag++e-=Ag;根据题目信息“产生的气体遇空气迅速变为红棕色”,可推测是“NO遇空气中的O2生成NO2”的现象,所以产生的气体是NO,再根据原子守恒,电荷守恒,写出反应为:NO3-+4H++3e-=NO↑+2H2O,
故答案为:Ag++e-=Ag;NO3-+4H++3e-=NO↑+2H2O.
点评 此类题目,一定要理解题意,抓住“暗含”信息,结合化学原理解答,较为简单,但必须要细心.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 非极性共价键只能存在于非金属单质中,不可能存在于化合物中 | |
| C. | 含有离子键的化合物一定是离子化合物,在离子化合物中可以含有非极性共价键 | |
| D. | 凡是能电离出离子的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物光合作用过程中是由太阳能转变成化学能 | |
| B. | 研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放 | |
| C. | 煤、石油、天然气属于可再生能源 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体CO2(HCl):通过饱和NaHCO3溶液 | B. | 固体Na2CO3(NaHCO3):加热 | ||
| C. | 气体Cl2(HCl):通过NaOH溶液 | D. | FeCl3溶液(FeCl2):通入Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
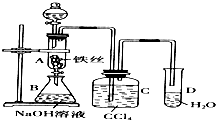 某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)
某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com