
Äѻӷ¢ŠŌ¶žĮņ»Æīć£ØTaS2 £©æɲÉÓĆČēĻĀ×°ÖĆĢį“攣½«²»“æµÄTaS2 ·ŪĩװČėŹÆÓ¢¹ÜŅ»¶Ė£¬³éÕęæÕŗó¼ÓČėŹŹĮæµā²¢·ā¹Ü£¬ÖĆÓŚ¼ÓČČĀÆÖŠ£¬·¢Éś·“Ó¦£ŗ  ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®ŌŚ²»Ķ¬ĪĀ¶ČĒųÓņ£¬TaI4 µÄĮæ±£³Ö²»±ä
B£®ŌŚĢį“æ¹ż³ĢÖŠ£¬I2 µÄĮæ²»¶Ļ¼õÉŁ
C£®øĆ·“Ó¦µÄĘ½ŗā³£ŹżÓėTaI4 ŗĶS2 µÄÅØ¶Č³Ė»ż³É·“±Č
D£®ŌŚĢį“æ¹ż³ĢÖŠ£¬I2 µÄ×÷ÓĆŹĒ½«TaS2 “ÓøßĪĀĒų×ŖŅʵ½µĶĪĀĒų
D
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA£®ŌŚĪĀ¶Č½Ļøߏ±·¢Éś·“Ó¦²śÉśTaI4£¬ŌŚĪĀ¶Č½ĻµĶŹ±£¬TaI4·Ö½ā²śÉśTaI2£¬Ņņ“ĖŌŚ²»Ķ¬ĪĀ¶ČĒųÓņ£¬TaI4 µÄĮæ²»Ķ¬£¬“ķĪó£»B£®ŌŚĢį“æ¹ż³ĢÖŠ£¬øł¾ŻŌŖĖŲŹŲŗćæÉÖŖI2 µÄĮæ»į²»ŌŁ±ä»Æ£¬“ķĪó£»C£®øĆ·“Ó¦µÄĘ½ŗā³£ŹżÓėTaI4 ŗĶS2 µÄÅØ¶Č³Ė»ż³ÉÕż±Č£¬“ķĪó£»D£®øł¾ŻĪļÖŹ±ä»ÆµÄĢõ¼žæÉÖŖ£ŗŌŚĢį“æ¹ż³ĢÖŠ£¬I2 µÄ×÷ÓĆŹĒ½«TaS2 “ÓøßĪĀĒų×ŖŅʵ½µĶĪĀĒų£¬ÕżČ·”£
æ¼µć£ŗæ¼²éĪļÖŹµÄĢį“æ·“Ó¦ŌĄķ¼°Ģõ¼ž±ä»ÆµÄÖŖŹ¶”£


 ½šŌæ³×ŹŌ¾ķĻµĮŠ“š°ø
½šŌæ³×ŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ½ĖÕŹ”¶«ĢØŹŠø߶žµŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĶ¼ŹĒijӊ»śĪļŗĖ“Ź²ÕńĒāĘ×Ķ¼£¬µ«øĆĪļÖŹæÉÄÜŹĒ
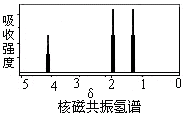
A£®CH3COOCH2CH3
B£®CH3CH=CHCH3
C£®CH3CH2CH3
D£®CH3CHOHCH3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”½ŅŃōŹŠø߶žµŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
M2O7X-ÓėS2-ŌŚĖįŠŌČÜŅŗÖŠ·“Ó¦ČēĻĀ£ŗM2O7X£+3S2£+14H+£½2M3++3S”ż+7H2O£¬ŌņM2O7X£ÖŠMµÄ»ÆŗĻ¼ŪŹĒ
A£®+2 B£®+3 C£®+4 D£®+6
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĪĀ¶ČĪŖTŹ±£¬Ļņ2.0LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0 molPCl5£¬·“Ó¦PCl5(g) PCl3(g)£«Cl2(g)¾Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
PCl3(g)£«Cl2(g)¾Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®·“Ó¦ŌŚĒ°50 sµÄĘ½¾łĖŁĀŹĪŖv(PCl3)=0.0032 mol”¤L-1”¤s-1
B£®±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±£¬c(PCl3)=0.11 mol”¤L-1£¬Ōņ·“Ó¦µÄ”÷H£¼0
C£®ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1.0molPCl5”¢0.20molPCl3ŗĶ0.20molCl2£¬“ļµ½Ę½ŗāĒ°v(Õż)>v(Äę)
D£®ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0molPCl3”¢2.0molCl2£¬“ļµ½Ę½ŗāŹ±£¬PCl3µÄ×Ŗ»ÆĀŹ“óÓŚ80%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚĻĀĮŠČÜŅŗÖŠ£¬ø÷×éĄė×ÓŅ»¶ØÄܹ»“óĮæ¹²“ęµÄŹĒ
A£®ŌŚŗ¬ÓŠNaHCO3µÄČÜŅŗÖŠ£ŗK+”¢SO42-”¢Cl-”¢Al3+
B£®Ź¹¼×»ł³Č±äŗģµÄČÜŅŗ£ŗFe2+”¢Mg2+”¢NO3-”¢Cl-
C£®c(H+) = 10-12 mol”¤L-1µÄČÜŅŗ£ŗK+”¢Ba2+”¢Cl-”¢Br-
D£®Ė®µēĄėµÄc(H+) = 10-11 mol”¤L-1µÄČÜŅŗ£ŗNH4+”¢K+”¢ClO-”¢Cl-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĪļÖŹ·ÖĄą×éŗĻÕżČ·µÄŹĒ
| A | B | C | D |
Ēæµē½āÖŹ | AlCl3 | HClO4 | H3PO4 | HClO |
Čõµē½āÖŹ | CH3COOH | HF | BaSO4 | Ca(OH)2 |
·Ēµē½āÖŹ | ¾Ę¾«ČÜŅŗ | NH3 | H2O | SO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĪÄ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŹµŃé²Ł×÷ÖŠ£¬²»ÕżČ·µÄŹĒ
A£®ĪŖŹ¹¹żĀĖĖŁĀŹ¼Óæģ£¬æÉÓĆ²£Į§°ōŌŚ¹żĀĖĘ÷ÖŠĒįĒį½Į°č£¬¼ÓĖŁŅŗĢåĮ÷¶Æ
B£®ÓĆ¾Ę¾«µĘøųŹŌ¹Ü¼ÓČČŹ±£¬ŅŖ½«±»¼ÓČȵďŌ¹Ü·ÅŌŚ¾Ę¾«µĘ»šŃęµÄĶāŃęÉĻ
C£®ĪŖ¼ÓĖŁ¹ĢĢåĪļÖŹµÄČܽāÖ»ÄܲÉÓĆ¼ÓČȵķ½·Ø
D£®ĪŖŌö“óĘųĢåĪļÖŹµÄČܽā¶Č£¬³£²ÉČ”½Į°č”¢¼ÓČȵȓėŹ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĪÄ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ“ėŹ©²»ÄÜÓŠŠ§·ĄÖ¹øÖĢśøÆŹ“µÄŹĒ
A£®ŌŚøÖĢśÖŠ¼ÓČėøõÖĘ³É²»ŠāøÖ
B£®°ŃøÖĢśĮć¼ž·ÅŌŚ»śÓĶÖŠ±£“ę
C£®ŌŚ½ĻŠ”øÖĢśÖĘĘ·µÄ±ķĆę°ü¹üĖÜĮĻ
D£®ŌŚ“óŠĶĢśæĒ“¬±ķĆęÅēĶæÓĶĘį²¢ĆÉĻĶæé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”¹ćÖŻŹŠø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»Æѧ£ØĄķ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(16·Ö)£ØŅ»£©Ä³Š”×éĄūÓĆH2C2O4ČÜŅŗŗĶĖįŠŌKMnO4ČÜŅŗ·“Ó¦Ą“Ģ½¾æ”°Ķā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ”±”£ŹµŃ鏱£¬Ķعż²ā¶ØĶŹÉ«ĖłŠčŹ±¼äĄ“ÅŠ¶Ļ·“Ó¦µÄæģĀż”£ĻŽŃ”ŹŌ¼ĮÓėŅĒĘ÷£ŗ0.20mol/LH2C2O4ČÜŅŗ£¬0.010mol/L ĖįŠŌKMnO4ČÜŅŗ£¬ÕōĮóĖ®£¬×¶ŠĪĘ棬ŗćĪĀĖ®Ō”²Ū£¬ĮæĶ²£¬Ćė±ķ”£øĆŠ”×éÉč¼ĘĮĖČēĻĀµÄ·½°ø”£
ĪļĄķĮæ |
| H2C2O4ČÜŅŗ | ĖįŠŌKMnO4ČÜŅŗ | ĪĀ¶Č/”ę | ||
| ÅضČ/ mol”¤L-1 | Ģå»ż/mL | ÅضČ/ mol”¤L-1 | Ģå»ż/mL | ||
¢Ł | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
¢Ś | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
¢Ū |
|
|
| 0.010 | 4.0 | 25 |
£Ø1£©ŅŃÖŖ·“Ó¦ŗóH2C2O4×Ŗ»ÆĪŖCO2ŅŻ³ö£¬KMnO4×Ŗ»ÆĪŖMnSO4”£ĪŖĮĖ¹Ū²ģµ½×ĻÉ«ĶŹČ„£¬H2C2O4ÓėKMnO4³õŹ¼µÄĪļÖŹµÄĮæŠčŅŖĀś×ćµÄ¹ŲĻµĪŖ£ŗn(H2C2O4)£ŗn (KMnO4) ”Ż_______”£
£Ø2£©ĒėĶź³É±ķøńÄŚĪ哦æÕ°×”£
£Ø3£©ŹµŃé¢Ū²āµĆKMnO4ČÜŅŗµÄĶŹÉ«Ź±¼äĪŖ40s£¬ŗöĀŌ»ģŗĻĒ°ŗóČÜŅŗĢå»żµÄĪ¢Š”±ä»Æ£¬Õā¶ĪŹ±¼äÄŚĘ½¾ł·“Ó¦ĖŁĀŹv£ØKMnO4£©£½______________ mol”¤L-1”¤min-1”£
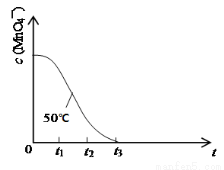
£Ø4£©ŅŃÖŖ50”ꏱc(MnO4”Ŗ)”«·“Ó¦Ź±¼ätµÄ±ä»ÆĒśĻßČēĻĀĶ¼”£ĘäÖŠ·“Ó¦ĖŁĀŹ×īæģµÄ½×¶ĪŹĒ_____£¬ŌŅņŹĒ ”£
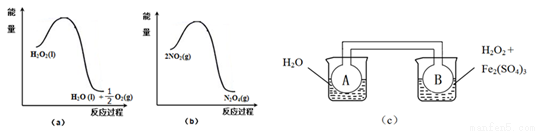
£Ø¶ž£©ĄūÓĆĻĀĶ¼£Øa£©ŗĶ£Øb£©ÖŠµÄŠÅĻ¢£¬°“Ķ¼£Øc£©×°ÖĆ£ØĮ¬ĶصÄA”¢BĘæÖŠŅŃ³äÓŠNO2ĘųĢ壩½ųŠŠŹµŃ锣æɹŪ²ģµ½BĘæÖŠĘųĢåŃÕÉ«±ČAĘæÖŠµÄ_________£ØĢī”°Éī”±»ņ”°Ē³”±£©£¬ĘäŌŅņŹĒ_________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com