
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
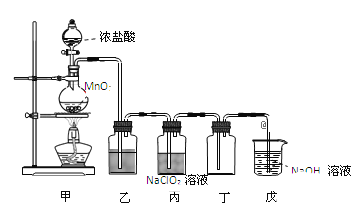
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
【答案】4HCl(浓)+2MnO2![]() MnCl2+Cl2↑+2H2O Cl2 + H2O
MnCl2+Cl2↑+2H2O Cl2 + H2O![]() HClO + HCl 饱和食盐水 吸收未反应完的氯气和二氧化氯,防止污染环境 2ClO2 + 2OH- == ClO
HClO + HCl 饱和食盐水 吸收未反应完的氯气和二氧化氯,防止污染环境 2ClO2 + 2OH- == ClO![]() + ClO
+ ClO![]() + H2O
+ H2O
【解析】
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2和H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl和HClO;
(3)由题干信息可知,装置乙的作用是除Cl2中HCl,分析乙装置内液体;装置戊的作用是吸收尾气;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,根据化合价升降守恒、电荷守恒、原子守恒配平。
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2和H2O,反应方程式为:4HCl(浓)+2MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl和HClO,反应方程式为:Cl2 + H2O![]() HClO + HCl;
HClO + HCl;
(3)Clˉ存在时会催化ClO2的生成,若无乙装置,则丙装置内产生ClO2的速率明显加快导致ClO2浓度过高,易发生分解甚至爆炸,故装置乙的作用是除Cl2中HCl,可选用试剂为饱和食盐水;氯气和二氧化氯均为有毒气体,不能直接排放至空气中,因此需要进行尾气处理,故装置丙的作用是:吸收未反应完的氯气和二氧化氯,防止污染环境;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,ClO2被氧化为ClO3-(化合价升高1),ClO2同时被还原为ClO2-(化合价降低1),根据化合价升降守恒和电荷守恒、原子守恒配平可得其反应的离子方程式:2ClO2 + 2OH- ==ClO2-+ClO3-+H2O


科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )

A. 按气流流动的先后顺序,装置连接顺序依次为DACBE
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氧化铜溶液后溶液的pH升高。观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氧化铜溶液时pH变化如右图曲线关系。
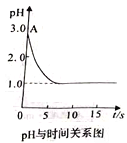
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A点位置的原因是____________。(用离子方程式说明)。
(2)“理论派”"所持观点的理论依据是_______________。
(3)“实验派”实验结论是________________。
(4)若“实验派”的观点正确,pH降低的原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物对应的水化物中酸性较强的是____(写出化学式)。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程:___。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ 的热量,请写出表示X2燃烧热的热化学方程式:_____。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为___;若B为常见家用消毒剂的主要成分,则B的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中如图所示的一些物质或概念间的从属关系,不正确的是( )
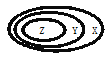
Z | Y | X | |
A | 氧化物 | 化合物 | 纯净物 |
B | 盐酸 | 电解质 | 化合物 |
C | 胶体 | 分散系 | 混合物 |
D | 碱性氧化物 | 金属氧化物 | 氧化物 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列溶液:100mL 2 mol·L-1 KCl溶液、100 mL 1mol·L-1 CaCl2溶液和200 mL 1mol·L-1FeCl3溶液,上述三种溶液中Cl-物质的量浓度之比为
A.1 :1:3B.1 :1:1C.2 :2:3D.1 :2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在元素周期表中的位置。
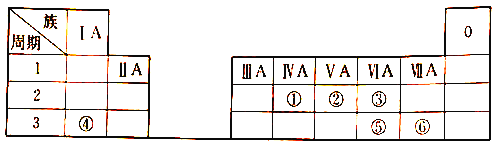
请回答下列问题:
(1) ①元素原子的质子数是_________。
(2)②元素的最简单氢化物的分子式是_______。
(3)③和⑤两种元素的非金属性: ③___⑤(填“>”“<”或“=”);
(4)④和⑥两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
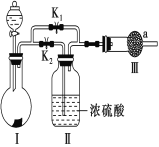
(1)过氧化钠与二氧化碳反应的化学方程式是_______________________________________________________,
该反应中,反应物的总能量________(填“大于”或“小于”)生成物的总能量。
(2)装置Ⅰ中的试剂是________(填字母)。
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹________(填“K1”或“K2”),观察到预期现象后,关闭它,再打开另一个弹簧夹。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是_______________________________________________________________________.
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是_______________________________________________________________________.
(5)为进一步达到实验目的,应补充的实验是:取最终反应后Ⅲ中所得固体,_______________________________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com