
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
一.溴乙烷的制备
反应原理和实验装置如下(加热装置、夹持装置均省略):
H2SO4+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O

(1)图中沸石的作用为_____________。若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了________;F连接导管通入稀NaOH溶液中,其目的主要是吸收_________等防止污染空气;导管E的末端须低于D中烧杯内的水面,其目的是_______________________________。
(2)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是_____________(保留3位有效数字)。
二.溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:

(3)在乙中试管内加入10mL6mol·L-1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______________________________________,证明溴乙烷与NaOH溶液已反应完全的现象是________________________________。
(4)若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图装置。a试管中的水的作用是________________;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为______________。

【答案】防暴沸 Br2 HBr、SO2、Br2 使溴乙烷充分冷却 53.4% CH3CH2Br+NaOH![]() CH3CH2OH+NaBr 试管乙中分层现象消失 吸收乙醇 溴水或溴的CCl4溶液
CH3CH2OH+NaBr 试管乙中分层现象消失 吸收乙醇 溴水或溴的CCl4溶液
【解析】
(1)产生的HBr是用NaBr和浓硫酸反应制备的,浓硫酸具有强氧化性,结合溴离子具有还原性分析解答;反应产生SO2,Br2,HBr气体,均会污染大气;导管E的作用是冷凝溴乙烷,据此分析解答;
(2)最终收集到10.0g馏分,为溴乙烷(CH3CH2Br),根据反应物中为10.0mL乙醇,结合反应方程式计算溴乙烷的理论产量,在计算产率;
(3)溴乙烷在NaOH水溶液中加热发生水解反应,产生的NaBr和乙醇均易溶于水,而溴乙烷难溶于水,据此分析解答;
(4)产生的乙烯中可能会混入乙醇,乙醇也能使酸性高锰酸钾溶液褪色,则应先除去混有的乙醇,再验证乙烯,结合乙烯和乙醇的性质的差异选择合适的试剂。
(1)加入沸石可以防止液体加热是发生暴沸;产生的HBr是用NaBr和浓硫酸反应制备的,若图甲中A加热温度过高或浓硫酸的浓度过大,浓硫酸具有强氧化性,反应温度过高会使反应剧烈,产生橙色的Br2,均会使C中收集到的粗产品呈橙色,发生反应的化学方程式为:2HBr+H2SO4(浓)=Br2+SO2+2H2O;反应产生SO2,Br2,HBr气体,会污染大气,应用NaOH溶液吸收,防止污染空气;
导管E的作用是冷凝溴乙烷,导管E的末端须低于D的水面,可以使溴乙烷充分冷却,提高产率,故答案为:防暴沸;Br2;SO2,Br2,HBr;使溴乙烷充分冷却,提高产率;
(2)10mL乙醇的质量为0.79×10g=7.9g,其物质的量为![]() =0.172mol,所以理论上制得溴乙烷的物质的量为0.172mol,其质量为0.172mol×109g/mol= 18.75g,实际上产量为10g,则溴乙烷的产率=
=0.172mol,所以理论上制得溴乙烷的物质的量为0.172mol,其质量为0.172mol×109g/mol= 18.75g,实际上产量为10g,则溴乙烷的产率=![]() ×100%=53.4%,故答案为:53.4%;
×100%=53.4%,故答案为:53.4%;
(3)在乙中试管内加入NaOH溶液和溴乙烷,振荡,二者发生溴乙烷的水解反应,反应的方程式为CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;溴乙烷难溶于水,而产物均易溶于水,因此验证溴乙烷与NaOH溶液已反应完全的现象是试管乙中分层现象消失,故答案为:CH3CH2Br+NaOH
CH3CH2OH+NaBr;溴乙烷难溶于水,而产物均易溶于水,因此验证溴乙烷与NaOH溶液已反应完全的现象是试管乙中分层现象消失,故答案为:CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;试管乙中分层现象消失;
CH3CH2OH+NaBr;试管乙中分层现象消失;
(4)为证明溴乙烷在NaOH乙醇溶液中反应的气体产物为乙烯,将生成的气体通入丙装置,随着反应的发生,产生的乙烯中可能会混有乙醇,乙醇也能使酸性高锰酸钾溶液褪色,则应先用水除去混有的乙醇,再验证乙烯,所以a试管中的水的作用是:吸收乙醇;若无a试管,b试管中的试剂应为能与乙烯反应而不与乙醇反应,可考虑溴水(或溴的CCl4溶液),故答案为:吸收乙醇;溴水(或溴的CCl4溶液)。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用Na2S沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )

A.向Cu2+浓度为1×10-5mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B.25℃时,Ksp(CuS)约为1×10-35
C.向100mLZn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3H2O吸收。已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为47之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。
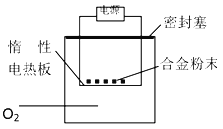
A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置(夹持仪器己略去)探究铁与浓硫酸的反应,下列实验不合理的是
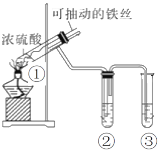
A.上下移动①中的铁丝可控制生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认产物中铁元素的价态,向①中加水,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
D.VL CO和NO的混合气体中含有的氧原子个数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量Na2O2和NaHCO3均匀混合物分成质量相等的甲乙两份。将甲投入100mL稀盐酸,固体完全溶解,收集到标况下的干燥气体2.24L。再将生成的气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L。根据以上信息,下列有关推断不正确的是( )
A. 甲乙两份混合物中均含Na2O2 0.16mol
B. 甲乙两份混合物中均含NaHCO3 0.02mol
C. 原混合物中Na2O2和NaHCO3物质的量之比无法确定
D. 盐酸物质的量浓度可能为3.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应,mX(g)+nY(g) ![]() qZ(g)的△H<0,m+n>q。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )
qZ(g)的△H<0,m+n>q。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )
A.△H增大B.υ(X)正:υ(Y)正=m:n
C.平衡常数K增大D.混合气体的平均相对分子质量变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com