
 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.分析 (1)根据盖斯定律方程式①-②+③×3得到CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)据此计算;
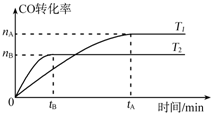
(2)①温度越高,反应速率越大,反应达到平衡时所用时间越短;
②升高温度平衡向吸热方向移动,结合反应热判断;
③平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,降低温度,反应速率减小,根据平衡移动判断平衡常数的变化.
解答 解:(1)已知常温常压下:
①CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H1=-1366.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③H2O(g)═H2O(l)△H3=-44kJ•mol-1
由盖斯定律方程式①-②+③×3得到CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=(-1366.8)-(-566)+(-44)×3kJ•mol-1=-932.8 kJ•mol-1,
故答案为:CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=-932.8 kJ•mol-1;
(2)①温度越高,反应速率越大,反应达到平衡时所用时间越短,由图象可知,T2温度时反应先达到平衡状态,即T2时速率快,温度高,所以T2大于T1;
故答案为:>;
②由图可知,升高温度,CO的转化率减小,即升高温度平衡向逆方向移动,则正反应为放热反应,即△H<0;
故答案为:<;逆;
③2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)的平衡常数的表达式为K=$\frac{c(C{H}_{3}C{H}_{2}OH)•c({H}_{2}O)}{{c}^{2}(CO)•{c}^{4}({H}_{2})}$,降低温度,反应速率减小,该反应为放热反应,降低温度平衡向正方向移动,化学平衡常数增大;
故答案为:K=$\frac{c(C{H}_{3}C{H}_{2}OH)•c({H}_{2}O)}{{c}^{2}(CO)•{c}^{4}({H}_{2})}$;变大;变小.
点评 本题考查了盖斯定律的应用和热化学方程式的书写、影响反应速率和化学平衡的因素、化学平衡常数等,题目难度中等,注意把握盖斯定律的含义和应用方法、以及温度对反应速率和化学平衡的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
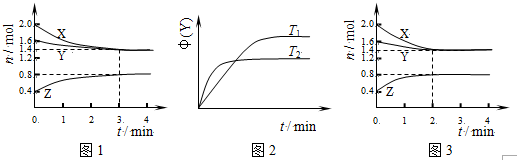
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com