
| A. | 混合碳酸氢钙与氢氧化钠溶液 | B. | 混合硫酸铝与氢氧化钠溶液 | ||
| C. | 混合浓氨水和硫酸铝溶液 | D. | 混合盐酸和硝酸银溶液 |
分析 A.一定反应生成碳酸钙沉淀;
B.NaOH少量时生成氢氧化铝、硫酸钠,NaOH过量时生成偏铝酸钠、硫酸钠;
D.一定生成氢氧化铝沉淀;
D.反应生成AgCl沉淀和硝酸.
解答 解:A.混合碳酸氢钙与氢氧化钠溶液,无论NaOH是否过量,均生成碳酸钙白色沉淀,故A不选;
B.混合硫酸铝与氢氧化钠溶液,若NaOH过量,没有沉淀生成,故B选;
C.混合浓氨水和硫酸铝溶液,反应生成氢氧化铝白色沉淀,故C不选;
D.混合盐酸和硝酸银溶液,反应生成AgCl白色沉淀,故D不选;
故选B.
点评 本题考查化学实验的评价,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物的性质及实验技能,题目难度不大.


科目:高中化学 来源: 题型:推断题
 .
.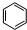 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$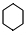 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | C. | Na、K、Rb | D. | SiC、NaCl、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
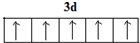 .
.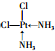 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
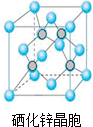 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
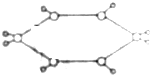 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )| A. | 属于芳香烃 | B. | 常温常压下为气体 | ||
| C. | 该烃的一氯代物有四种 | D. | 能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com