
| A.相同质量的O2和O3原子个数比为2:3 |
| B.O2和O3化学性质完全相同 |
| C.在相同温度与压强下,等体积的O2和O3含有相同的分子数 |
| D.O2和O3的相互转化是物理变化 |
科目:高中化学 来源:不详 题型:单选题
| A.因为SO2有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 |
| B.能使品红溶液褪色的不一定是SO2 |
| C.SO2、漂白粉、活性炭、Na2O2、H2O2、O3都能使红墨水褪色且其原理相同 |
| D.SO2和Cl2同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
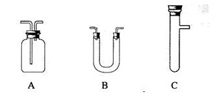
| 选用的仪器 (填字母) | 加入的试剂 | 作用 |
| (1) | 无水硫酸铜 | |
| (2) A | | |
| (3) | 酸性KMnO4溶液 | |
| (4) | | 检验SO2是否已除尽 |
| (5) A | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性) |
| B.在加热条件下铜与浓硫酸反应(氧化性、酸性) |
| C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) |
| D.浓硫酸可用来干燥某些气体(不挥发性) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| B.浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 |
| C.常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 |
| D.实验室可以用浓硝酸来制氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸具有脱水性 | B.浓硫酸具有吸水性 |
| C.盐酸具有挥发性 | D.气体的溶解度的随温度升高而降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S的还原性 | B.S的漂白性 | C.SO2的还原性 | D.SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2使高锰酸钾溶液褪色,说明SO2具有漂白性 |
| B.不小心将浓硫酸溅到手上,应立即用大量的水冲洗 |
| C.常温下浓硫酸可以用铝罐储存,说明铝能在冷的浓硫酸中钝化 |
| D.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I- 2
C6H6O6+2H++2I- 2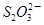 +I2
+I2
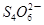 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。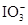 +5
+5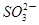 +2H+
+2H+ I2+5
I2+5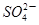 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 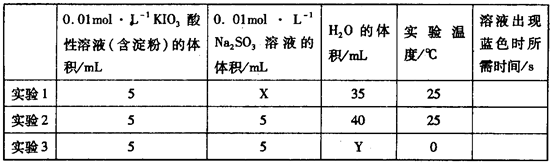
 Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com