
| A. | 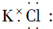 | B. |  | ||
| C. | 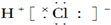 | D. | 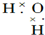 |
分析 A、氯化钾为离子化合物,电子式中需要标出阴阳离子所带电荷;
B、Na2O2是钠离子和过氧根离子构成的离子化合物;
C、HCl中Cl原子周围8个电子,H原子周围2个电子;
D、水为共价化合物,分子中存在2个氧氢键,氧原子最外层为8电子.
解答 解:A、KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ,故A错误;
,故A错误;
B、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故B正确;
,故B正确;
C、HCl中Cl原子周围8个电子,H原子周围2个电子,所以HCl的电子式为 ,故C错误;
,故C错误;
D、H2O中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故D错误,
,故D错误,
故选B.
点评 本题考查电子式的书写,难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Z>X>Y | C. | X>Z>Y | D. | Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
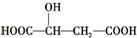 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com