
【题目】聚碳酸酯是热塑性材料,双酚A型聚碳酸酯的合成路线如下:
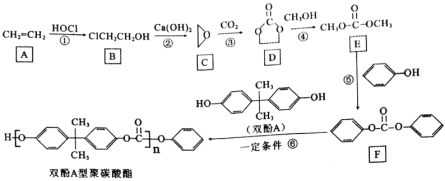
(1)B的化学名称为________,B中的官能团的名称是________。
(2)反应③的反应类型是________。
(3)写出D到E的反应方程式________。
(4)写出反应⑥中除生成双酚A型聚碳酸酯外的产物的结构简式________。
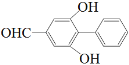
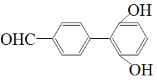
(5)写出满足下列条件的F的同分异构体的结构简式________(不考虑立体异构,只需写出2个)。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱有六组峰
(6)设计由1-丙醇制备![]() 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
【答案】2-氯乙醇 氯原子、羟基 加成反应 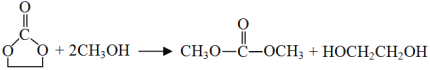
![]()
![]() 、
、  、
、  、
、
 、
、  、
、 ![]() 。
。
(任写2个) ![]()
![]()
或![]()
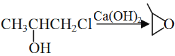
【解析】
A物质乙烯和HOCl发生加成反应生成B物质2-氯乙醇后,在Ca(OH)2的作用下生成C环氧乙烷,与二氧化碳发生加成反应生成D物质后在乙醇作用下生成E,E物质与苯酚反应生成F,F与双酚A发生加聚反应得到产物双酚A型聚碳酸酯,根据分析进行题目解答。
(1)物质A乙烯和HOCl发生加成反应生成B物质2-氯乙醇, B中的官能团为氯原子和羟基。
故答案为:2-氯乙醇,氯原子、羟基。
(2)C为环氧乙烷,二氧化碳中C=O断裂发生加成反应生成D物质。
故答案为:加成反应。
(3)根据题目内容,D物质与乙醇反应过程中开环,生成E和乙二醇,反应方程式为: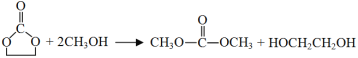 。
。
故答案为: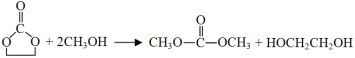 。
。
(4)![]() 和双酚A发生加成聚合反应生成双酚A型聚碳酸酯和苯酚,苯酚的结构简式为:
和双酚A发生加成聚合反应生成双酚A型聚碳酸酯和苯酚,苯酚的结构简式为:![]() 。
。
故答案为:![]() 。
。
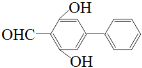
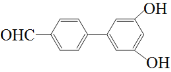
(5)由①能发生银镜反应条件可知含有醛基,②遇FeCl3溶液显紫色表明结构中含有酚羟基,③核磁共振氢谱有六组峰说明结构中含有6种不同结构的H,故符合题意的结构简式有:![]() 、
、  、
、  、
、 、
、  、
、 ![]() (任写2个)。
(任写2个)。
故答案为:![]() 、
、  、
、  、
、 、
、  、
、 ![]() (任写2个)。
(任写2个)。
(6)由1-丙醇制备![]() 的合成路线可参考从A物质乙烯到C物质环氧乙烷,1-丙醇在浓硫酸加热条件下生成丙烯,后与HOCl反应,最后经过与氢氧化钙反应得到产物
的合成路线可参考从A物质乙烯到C物质环氧乙烷,1-丙醇在浓硫酸加热条件下生成丙烯,后与HOCl反应,最后经过与氢氧化钙反应得到产物![]() 。反应路线为:
。反应路线为:![]()
![]() 或
或
![]()
![]() 。
。
故答案为:![]()
![]() 或
或![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上主要产钼国家之一,我国的钼资源十分丰富,以辉钼矿为主,是具有优势的战略资源。将辉钼矿精矿(主要成分为MoS2,杂质为CaCO3,SiO2,FeS2,CuFeS2,PbS等)除杂提纯可得到粗MoS2,通过精制转化最终可得到纯度更高的MoS2。
MoS2的相关信息:
①具有类似石墨的层状结构,有金属光泽,熔点1185℃,密度4.80g/cm-3,硬度很低,被广泛地应用在润滑领域。
②一般不溶于水、酸、碱和有机溶剂中,但溶于王水和煮沸的浓硫酸。Mo为+4价,在空气中加热至350℃以上开始被氧化,生成钼的氧化物。
有人提出了如下制取高纯MoS2的流程:

(1) MoS2可用作润滑添加剂的原因是:_____________。
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有:____________,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式:____________。
(3)“通空气并控温”这步操作的目的是:___________。必须控制好温度的原因:___________。
(4)“转化3”得到硫代钼酸铵(NH4)2MoS4。“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),写出该反应的离子方程式:____。
(5)上述流程中,哪些步骤发生了氧化还原反应:_____。
A.除杂1 B.除杂2 C.转化1 D.转化2 E.转化3 F.转化4 G.转化5
(6)上述流程中,可以循环使用的物质为(写化学式):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
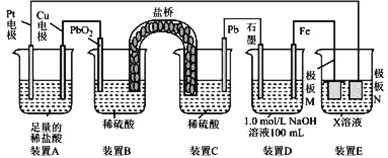
【题目】硫酸锰晶体(![]() )是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为
)是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 等杂质制取硫酸锰晶体,其具体流程如下:
等杂质制取硫酸锰晶体,其具体流程如下:
已知:①反应原理为:![]() ;
;
②![]() 难溶于水。
难溶于水。
(1)滤渣2主要成分是![]() ,步骤②中的稀硫酸的作用是________。
,步骤②中的稀硫酸的作用是________。
(2)步骤③中采用![]() 硫酸和草酸晶体溶解
硫酸和草酸晶体溶解![]() ,草酸晶体的作用是________;配制
,草酸晶体的作用是________;配制![]() 硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
(3)步骤④的具体实验操作有________,经洗涤后干燥得到![]() 晶体。
晶体。
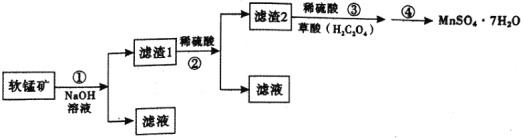
(4)兴趣小组同学拟继续研究硫酸锰的高温分解的固体产物,经查资料可知:硫酸锰晶体高温下分解产物为![]() 、
、![]() 、
、![]() ,及水蒸气。为了确定
,及水蒸气。为了确定![]() 的化学式,采用下面装置进行测定(已知:
的化学式,采用下面装置进行测定(已知:![]() 的熔点为16.8℃,沸点为44.8℃)。
的熔点为16.8℃,沸点为44.8℃)。
①![]() 装置中吸收的气体为________。
装置中吸收的气体为________。
②实验自始至终均需通入![]() ,其目的是________。
,其目的是________。
③若起始时,在装置A中加入![]() ,充分反应后,测得装置C增重6.4g,则
,充分反应后,测得装置C增重6.4g,则![]() 的化学式为________。
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B.向Al2(SO4)3溶液中加入少量氨水:![]()
C.向明矾溶液中加入过量的氢氧化钡溶液:![]()
D.向小苏打溶液中加少量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要95 mL l.0 mol/L稀硫酸,现用98%的浓硫酸(其密度为1.84 g.mL-l)来配制。
(1)实验需要的玻璃仪器有50 mL烧杯、玻璃棒、胶头滴管、____、____。
(2)玻璃棒的作用为____,胶头滴管的作用为________,
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)____。
A.将稀释的硫酸液转移至容量瓶后,洗涤烧杯和玻璃棒2-3次。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.容量瓶使用时未干燥。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
E.未冷却至室温就定容。
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O是红色粉末,常作颜料。某校化学实验小组通过实验来探究红色粉末的成分是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是____;若假设2成立,发生反应的离子方程式为______。
(2)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,设计实验计算二者的物质的量:取一定量的该固体粉末溶于500 mL未知浓度的稀硫酸溶液中,固体全部溶解,向反应后的溶液中加入Fe粉,溶液中部分离子的物质的量随Fe粉加入,变化如图所示,则Fe2O3和Cu2O的物质的量分别为____、 _______。
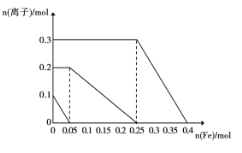
(3)硫酸溶液的物质的量浓度是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分连接装置省略)如图:
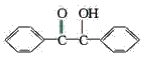 +2FeCl3
+2FeCl3 +2FeCl2+2HCl
+2FeCl2+2HCl
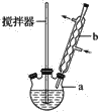
装置图中的两种玻璃仪器a为三颈烧瓶、b为球形冷凝管(或冷凝管),在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
根据以上信息请回答下列问题:
(1)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体___。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用____等方法促进晶体析出。
(2)试推测抽滤所用的滤纸应略___(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是__。
A.无水乙醇
B.饱和NaCl溶液
C.70%乙醇水溶液
D.滤液
(3)上述重结晶过程中的哪一步操作除去了不溶性杂质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com