
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同? .
(2)写出实验3中的电极反应式和电池总反应方程式.铝电极 . 石墨电极 电池总反应: .
(3)实验4中的铝作正极还是负极? ,为什么? .
(4)实验5中,负极反应为 .
考点:
探究原电池及其工作原理.
专题:
电化学专题.
分析:
(1)氧化还原反应中失电子的金属做负极;
(2)原电池中,较活泼的金属一般做负极,非金属电极为正极,据此写出电极反应及电极总反应;
(3)金属铝和氢氧化钠可以发生氧化还原反应,失电子的是金属铝,为原电池的负极;
(4)铝与浓硝酸发生钝化,反应锌为负极,负极锌失去电子生成锌离子.
解答:
解:(1)实验1中,氧化还原反应发生在金属镁和稀盐酸之间,失电子的是金属镁,为负极金属,实验2中,氧化还原反应发生在金属铝和稀盐酸之间,失电子的是金属铝,为负极金属,所以实验1、2中Al所作的电极不相同,
故答案为:不同;
(2)Al、石墨、盐酸构成的原电池中,较活泼的金属铝做负极,电极反应为:2Al﹣6e﹣→2Al3+;石墨电极为正极,电极反应为:6H++6e﹣→3H2↑,电解总反应为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al﹣6e﹣→2Al3+;6H++6e﹣→3H2↑;2Al+6H+=2Al3++3H2↑;
(3)实验4中,金属铝和氢氧化钠可以发生自发的氧化还原反应,失电子的是金属铝,为原电池的负极,自发的氧化还原反应即为电池的总反应,故答案为:负极;因为Al能和NaOH溶液反应而Mg不能;
(4)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,负极锌失去电子生成锌离子,负极反应为:Zn﹣2e﹣=Zn2+,
故答案为:Zn﹣2e﹣=Zn2+.
点评:
本题考查原电池原理,明确发生的原电池反应及正负极的判断是解答本题的关键,题目难度不大,注意利用氧化还原反应中电子的得失来分析正负极.


科目:高中化学 来源: 题型:
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
②用标准溶液润洗滴定管2﹣3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2﹣3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶 .
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是( )
①滴有石蕊试液的碳酸
②滴有石蕊试液的NH4Cl溶液
③滴有石蕊试液的硫酸
④滴有酚酞试液的氨水
⑤滴有酚酞试液的氢氧化钠溶液
⑥滴有酚酞试液的饱和氢氧化钙溶液
⑦滴有酚酞试液的Na2CO3溶液
⑧溶有SO2的品红溶液.
|
| A. | ①④⑥ | B. | ④⑥ | C. | ③⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
|
| A. | a=b |
|
| B. | 混合溶液的pH=7 |
|
| C. | 混合溶液中,c(H+)= |
|
| D. | 混合溶液中,c(H+)+c(B﹣)=c(OH﹣)+c(A﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
如果类似于水的离子积Kw,溶液中c(Ag+)和c(Cl﹣)的乘积是一个常数:c(Ag+)•c(Cl﹣)=1.0×10﹣10,当溶液中c(Ag+)•c(Cl﹣)大于1.0×10﹣10时,才可能产生AgCl沉淀.现向50mL 0.018mol•L﹣1的AgNO3溶液中加入50mL 0.02mol•L﹣1的盐酸,生成了沉淀.求:
(1)沉淀生成后溶液中c(Ag+)是多少?
(2)沉淀生成后溶液的pH是多少?
(3)如果向沉淀生成后的溶液中再加入50mL 0.001mol•L﹣1的盐酸,将会观察到什么现象?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水的电离平衡曲线如图所示,下列说法正确的是 ( )。
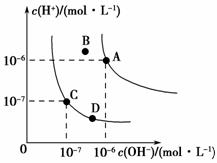
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可以从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列区分Fe(OH)3悬浊液和Fe(OH)3胶体的方法中,正确的是()
A. 静置片刻出现分层现象的是Fe(OH)3胶体
B. 用放大镜观察,颗粒大小为1~100nm的是Fe(OH)3胶体
C. 用光束照射,能产生丁达尔现象的是Fe(OH)3胶体
D. 看颜色,有色的是Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 卤代烃在NaOH存在下水解生成的有机物都是醇 |
|
| B. | 所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
|
| C. |
|
|
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com