
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
试回答:
(1)若X是强氧化性气体单质,则A可能是______(填序号)。
a.C b.Al c.Na d.Mg
(2) 若A、B、C均为含有同种金属元素的化合物,且A为氧化物,反应①中X是强碱,反应②中X为CO2,则C的化学式为_________,反应②的离子方程式____________________,反应②中CO2_______(填“能”或“否”)用盐酸或稀硫酸代替.
(3) 若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟。B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________________________;检验此C溶液中金属元素的操作方法是________________。
【答案】a cAl(OH)3AlO2`+CO2+2H2O==Al(OH)3+HCO3-否FeCl3防止二价铁被氧化成三价铁取C溶液少许于试管中,先加KSCN溶液不变血红色,再加入氯水变血红色
【解析】
(1)若A是非金属单质,X是强氧化性单质,A可发生连续氧化,则A为S或C、Na或N2,故答案为:ac;(2)若A、B、C均为含有同种金属元素的化合物,且A为氧化物,反应①中X是强碱,反应②中X为CO2,则可推断A为Al2O3,B为NaAlO2,C为Al(OH)3;反应②是偏铝酸钠溶液中通入二氧化碳反应生成氢氧化铝和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O==Al(OH)3+HCO3-;反应②中CO2不能用盐酸或稀硫酸代替,否则过量的盐酸会将产生的氢氧化铝溶解;(3)若X是金属单质,应为Fe,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,证明含有氯离子,证明A气体是Cl2,①B为FeCl3;C溶液在贮存时应加入少量Fe,理由是防止二价铁被氧化成三价铁; ②B为氯化铁,检验铁离子可取C溶液少许于试管中,先加KSCN溶液不变血红色,再加入氯水变血红色,证明该阳离子存在。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纯铁为灰黑色,所以铁属于黑色金属
B. 铁在硫蒸气中燃烧生成Fe2S3
C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D. 足量的铁在氯气中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO-), 下列说法正确的是( )
A. b<0.01
B. 混合后溶液呈碱性
C. 常温下,所得溶液中CH3COOH的的电离常数Ka=![]() mol·L-1
mol·L-1
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
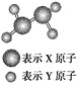
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选修3—有机化学基础)
8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
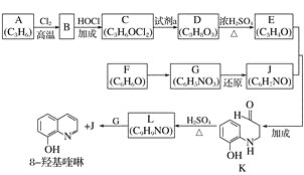
已知:ⅰ.![]()
ⅱ.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是________________。
(2)A→B的化学方程式是________________。
(3)C可能的结构简式是________________。
(4)C→D所需的试剂a是________________。
(5)D→E的化学方程式是________________。
(6)F→G的反应类型是________________。
(7)将下列K→L的流程图补充完整:
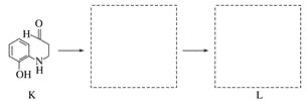 ___________________________
___________________________
(8)合成8羟基喹啉时,L发生了________(填“氧化”或“还原”)反应。反应时还生成了水,则L与G物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:___________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+![]() O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+![]() O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是___________。
(3)氢氧化镁可以作为阻燃剂的原因_________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
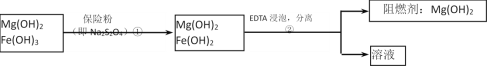
(4)步骤②中分离操作的名称是__________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是__________mol。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com