
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
分析 (1)酸性高锰酸钾是用稀硫酸酸化,混合溶液发生氧化还原反应,KMnO4被还原为MnSO4,H2C2O2被氧化为CO2,根据得失电子数守恒和原子守恒写出反应方程式;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究H2C2O4溶液浓度不同对反应速率的影响,则加入的H2C2O4溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;④中加了MnSO4固体,锰离子对该反应起催化作用;
(3)草酸是二元弱酸,应分步电离;
(4)为了观察到紫色褪去,草酸应该稍微过量.
解答 解:(1)酸性高锰酸钾是用稀硫酸酸化,H2SO4、KMnO4与H2C2O2发生反应,KMnO4被还原为MnSO4,化合价降低5价,H2C2O2被氧化为CO2,每个C原子的化合价升高1价,1个H2C2O2升高2价,则高锰酸钾与草酸计量数之比为2:5,根据原子守恒配平可得:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O,
故答案为:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6.0mL,则a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间(t溶液褪色时间/s);其他条件相同,④中加了MnSO4固体,锰离子对该反应起催化作用,则②④探究的是催化剂对反应速率的影响,
故答案为:温度;1.0;t溶液褪色时间/s;催化剂;
(3)草酸(H2C2O4)是一种二元弱酸,分步电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(4)高锰酸钾和草酸反应方程式为5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O,为了观察到紫色褪去,草酸应该稍微过量,所以n(H2C2O4):n(KMnO4)≥2.5,
故答案为:2.5(或5:2).
点评 本题考查了弱酸的电离方程式书写、氧化还原反应方程式书写以及影响化学反应速率因素的实验探究,对于影响反应速率的因素的探究,应注意的是当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,难度中等.


科目:高中化学 来源: 题型:解答题
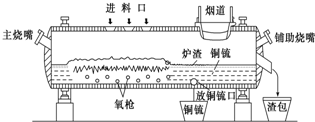
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X属于非金属元素 | B. | 对应的氢化物的热稳定性:W>Y | ||
| C. | W与Z易于形成离子化合物 | D. | Z离子的氧化性强于X离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H>0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 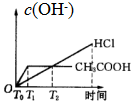 | B. | 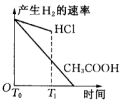 | C. |  | D. | 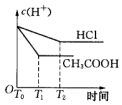 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
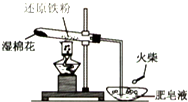 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com