
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
分析 ①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由+4价升高为+6价;
②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O中,Cu元素的化合价既升高又降低,以此来解答.
解答 解:A.①②中Cu元素的化合价均发生变化,均属于氧化还原反应,故A错误;
B.①中二氧化硫作还原剂,故B错误;
C.反应②中Cu元素的化合价升高,失去电子被氧化,则CuSO4是氧化产物,故C正确;
D.反应①中由S元素失去电子被氧化可知SO2发生氧化反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
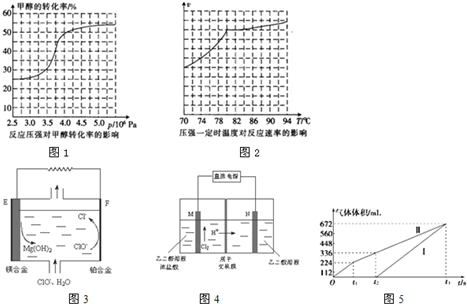
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117 g该元素原子的物质的量为1 mol | |
| B. | 该元素一定为非金属元素 | |
| C. | 该元素在地球上的含量十分丰富 | |
| D. | 该元素的金属性可能比非金属性更明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com