
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如图所示。
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
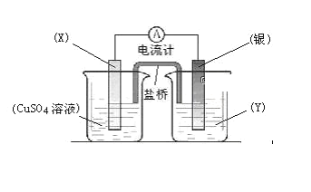
请回答下列问题:
(1)电极X的材料是_______;电解质溶液Y是____________;
(2)银电极为电池的___极,发生的电极反应为_____________;X电极上发生的电极反应为___________;
(3)外电路中的电子是从_______电极流向___________电极;
(4)如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,则
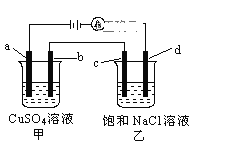
①a电极反应式为_________________________________;
②乙中的总反应为__________________________________;
③若整个电路中有2NA 个电子转移,则d电极产生__________L气体 (标准状况)。
【答案】Cu AgNO3 正 Ag++e– = Ag Cu―2e– = Cu2+ Cu(或X) Ag 4OH-―4e–= O2↑ +2H2O 2NaCl+2H2O=2NaOH+H2↑+Cl2↑ 22.4L
【解析】
(1)-(3)根据反应“![]() "分析,在反应中,Cu被氧化,失电子,应为原电池的负极,在正极上得电子被还原,电解质溶液
"分析,在反应中,Cu被氧化,失电子,应为原电池的负极,在正极上得电子被还原,电解质溶液![]() ,正极为活泼性较Cu弱的Ag,依据原电池原理进行分析可得;
,正极为活泼性较Cu弱的Ag,依据原电池原理进行分析可得;
(4)装置甲乙连接组成为电解池,可以依据电解池中离子放电顺序进行解析。
(1)由反应“![]() ”,在反应中,Cu被氧化,失电子,应为原电池的负极,
”,在反应中,Cu被氧化,失电子,应为原电池的负极, ![]() 在正极上得电子被还原,电解质溶液AgNO3, 故答案为Cu;AgNO3;
在正极上得电子被还原,电解质溶液AgNO3, 故答案为Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,![]() 在正极上得电子被还原,电极反应为
在正极上得电子被还原,电极反应为![]() ,答案为:正,
,答案为:正,![]()
(3)原电池中,电子从负极经外电路流向正极,题中由Cu极经外电路流向Ag极,故答案为:Cu(或X);
(4) 由图可知该装置为电解池装置,a、c为阳极,b、d为阴极,由电解池中“阳氧阴还”可知:
①a电极反应式为![]() ;
;
②乙中的总反应为![]() ;
;
③由图可知d极电极反应式为:![]() 可知转移2mol电子时生成1mol氢气,由n=
可知转移2mol电子时生成1mol氢气,由n=![]() 可知体积为22.4L。
可知体积为22.4L。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将_______(填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________g。
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:
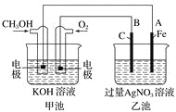
①甲池是________装置;通入CH3OH的电极名称是______,
②写出通入O2的电极的电极反应式是________________。
③A电极的电极反应式为_________________________。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒、烧杯外,还需要的玻璃仪器有__________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是__________。判断滴定终点的现象是_____
(3)实验2,滴定前液面在“0”刻度处,滴定后液面如图所示,其读数为________mL。根据上述数据,可计算出该盐酸的浓度为__________。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有(_______)
A. 配制标准溶液定容时,仰视刻度线
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结也可制取Cu2O。已知反应:
①2Cu(s) + O2(g) = 2CuO(s) ΔH = 314 kJ/mol
②2Cu2O(s) + O2(g) = 4CuO(s) ΔH = 292 kJ/mol
则反应CuO(s) 与Cu(s) 反应生成Cu2O(s) 的热化学方程式是( )
A.CuO(s) + Cu(s) = Cu2O(s) ΔH = 22 kJ/mol
B.CuO(s) + Cu(s) = Cu2O(s) ΔH = +22 kJ/mol
C.CuO(s) + Cu(s) = Cu2O(s) ΔH = 11 kJ/mol
D.CuO(s) + Cu(s) = Cu2O(s) ΔH = +11 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
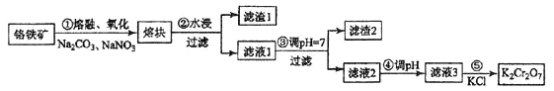
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.银氨溶液的配制:在洁净的试管中加入2%AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止
B.丙醛在催化剂存在下与氢气反应是还原反应,甲醛与新制的Cu(OH)2发生的是氧化反应
C.为了鉴别己烯、甲苯和丙醛,可以使用新制Cu(OH)2悬浊液与溴水
D.乙醇的球棍模型为:![]() ,分子式为CH3CH2OH
,分子式为CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com