
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
分析 A、蔗糖是非还原性糖,与氢氧化铜不反应,乙醇不与氢氧化铜反应;
B、乙烯与HCl属于加成反应,烷烃发生的是取代反应;
C、依据碳减法书写即可,需要满足含有三个甲基,即只有1个支链;
D、苯能燃烧,据此解答即可.
解答 解:A、蔗糖与乙醇与新制Cu(OH)2悬浊液均不能反应,故不能区分两者,故A错误;
B、乙烯与HCl是发生的加成反应,乙烷与Cl2发生的是取代反应,两者反应类型不同,故B正确;
C、C6H14符合条件的同分异构体只有2-甲基戊烷、3-甲基戊烷两种,故C错误;
D、苯能燃烧,有机物的燃烧属于氧化反应,故D错误,
故选B.
点评 本题主要考查的是有机物的鉴别、同分异构体个数判断、苯的化学性质、常见有机化学反应类型判断等,综合性较强,但是难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 该温度下NaHSO3 的水解平衡常数Kh=1×10-2 | |
| B. | 若向NaHSO3 溶液中加入少量的I2,则溶液中$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将减小 | |
| C. | 略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 | |
| D. | NaHSO3溶液中:c(H+)<c(S${O}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电能是现代社会应用最广泛,使用最方便,污染最小的二次能源 | |
| B. | 目前我国发电总量中火电所占比率最多 | |
| C. | 燃煤发电过程中能量转换方式为:化学能→热能→机械能→电能 | |
| D. | 火力发电过程中能量转化率很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 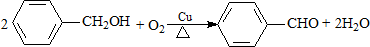 | |
| C. | 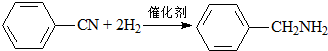 | |
| D. | 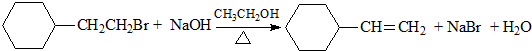 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH大小顺序是③>①>② | |
| B. | 分别向其中逐滴滴入相同浓度的盐酸至中性,消耗盐酸最少的是② | |
| C. | 分别稀释相同倍数后,pH变化最大的是② | |
| D. | 分别加入25mL 0.1 mol•L-1盐酸后,pH最大的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
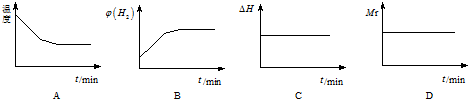
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ②③⑤⑦ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
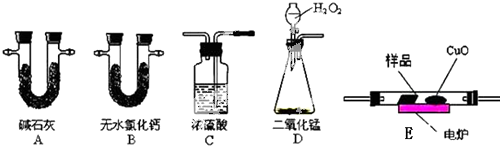
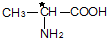 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com