
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
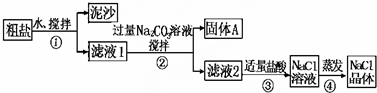
分析 由流程可知,粗盐溶于水后过滤分离出泥沙,滤液1中加碳酸钠,除去钙离子,过滤分离出A为碳酸钙或含碳酸钡,滤液2含NaCl、碳酸钠,再加适量盐酸除去碳酸钠,对溶液蒸发得到NaCl,
(1)步骤①和②,均分离不溶性固体与溶液;
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,防止局部温度过高,且出现大量固体时停止加热,利用余热加热;
(3)猜想I,若含BaCO3,溶于盐酸或硝酸后,再加硫酸钠生成白色沉淀;
猜想Ⅱ,NaCl中若含Na2SO4,与氯化钡反应生成不溶于酸的白色沉淀,以此来解答.
解答 解:由流程可知,粗盐溶于水后过滤分离出泥沙,滤液1中加碳酸钠,除去钙离子,过滤分离出A为碳酸钙或含碳酸钡,滤液2含NaCl、碳酸钠,再加适量盐酸除去碳酸钠,对溶液蒸发得到NaCl,
(1)步骤①和②,均分离不溶性固体与溶液,操作名称均为过滤,故答案为:过滤;
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干,
故答案为:局部过热,造成固体(或溶液)飞溅; 停止加热(或熄灭酒精灯);
(3)猜想I,若含BaCO3,则加过量稀硝酸(或稀盐酸)生成气体,再加硫酸钠生成白色沉淀,可知猜想Ⅱ不成立,因钡离子与硫酸根离子不能共存;
猜想Ⅱ,NaCl中若含Na2SO4,取少量NaCl晶体溶于试管中的蒸馏水,先滴入BaCl2溶液,再滴入过量稀HNO3,有白色沉淀,则猜想Ⅱ成立,
故答案为:
| 猜想 | 验证的操作 | 现象 | 结论 |
| 过量稀硝酸(或稀盐酸) | 猜想Ⅱ不成立 | ||
| 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 |
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中发生的反应、混合物分离方法、离子检验为解答的关键,侧重分析与实验能力的考查,注意物质组成的探究实验设计,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| C. | Fe与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ba(OH)2和CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| C | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| D | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热交换器 | B. | 沸腾炉 | C. | 吸收塔 | D. | 接触室 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com