
 回答下列问题.
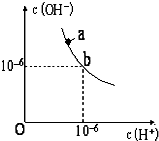
回答下列问题.分析 (1)由图可知,b点为中性,c(H+)=c(OH-)=10-6mol/L,该温度下,pH=12的NaOH,c(OH-)=1mol/L,pH=2的H2SO4c(H+)=0.01mol/L,等体积混合时碱过量;
(2)能提高NO2转化率,则改变条件使平衡正向移动,但不能加NO2;
(3)由Ka可知酸性强弱,84消毒液中通入少量的CO2,发生强酸制取弱酸的反应;
(4)Fe(OH)3的Ksp=1×10-38,结合c(OH-)=$\root{3}{\frac{Ksp}{c(F{e}^{3+})}}$计算;
(5)由CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)可知,K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$,以此计算.
解答 解:(1)由图可知,b点为中性,c(H+)=c(OH-)=10-6mol/L,可知a点离子积KW=10-12mol2•L-2;该温度下,pH=12的NaOH,c(OH-)=1mol/L,pH=2的H2SO4c(H+)=0.01mol/L,等体积混合时碱过量,则溶液显碱性,
故答案为:10-12;碱;
(2)2NO2(g)═N2O4(g)△H=-57.20kJ•mol-1,为提高NO2转化率,则
A.减小NO2的浓度,平衡逆向移动,转化率减小,故A不选;
B.该反应为放热反应,降低温度,平衡正向移动,转化率增大,故B选;
C.增加N2O4的浓度,平衡逆向移动,转化率减小,故C不选;
D.升高温度,平衡逆向移动,转化率减小,故D不选;
故选B;
(3)由Ka可知碳酸的酸性>HClO,则84消毒液中通入少量的CO2的反应为NaClO+CO2+H2O═HClO+NaHCO3,故答案为:NaClO+CO2+H2O═HClO+NaHCO3;
(4)Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,c(OH-)=$\root{3}{\frac{Ksp}{c(F{e}^{3+})}}$=$\root{3}{\frac{1×1{0}^{-38}}{1×1{0}^{-5}}}$=10-11mol/L,常温下c(H+)=10-3mol/L,即溶液的pH最小为3,
故答案为:3;
(5)Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,由CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)可知,K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{4.95×1{0}^{-5}}{2.80×1{0}^{-9}}$=1.77×104,故答案为:1.77×104.
点评 本题考查较综合,涉及酸碱混合计算、化学平衡移动、溶度积计算、化学平衡常数计算等,综合性较强,注重化学反应原理的训练,侧重分析与计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 | |
| C. | 为加速固体物质的溶解只能采用加热的方法 | |
| D. | 为增大气体物质的溶解度,常采取搅拌、加热等措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ⑤⑥⑦⑨ | C. | ①⑤⑥⑦⑨ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )| A. | △H>0,m+n>x | B. | △H>0,m+n<x | C. | △H<0,m+n<x | D. | △H<0,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| C. | 50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA | |
| D. | 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 | |
| B. | 物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=13的强碱溶液,加水稀释后,溶液中氢离子的浓度变小 | |
| D. | 25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的氢离子的浓度之比为104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com