
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是 ( )
A. 负极的电极反应式为:CH4—8e-+10OH-=CO32-+7H2O
B. 负极的电极反应式为:4OH--4e-=2H2O+O2↑
C. 标准状况下,通入5.6 LO2并完全反应后,有2.00mol电子转移
D. 放电一段时间后,通入O2的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,请回答:
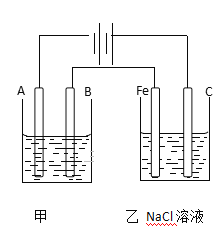
(1)甲池若为用电解精炼铜的装置,A是_________极,材料是__________,电极反应为_____________,B是___________极,材料是_______________,电极反应为_________,电解质溶液为________。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com